기본 화학: 산화 상태
많은 학교 교과서와 매뉴얼에서는 이온 결합이 있는 화합물에 대해서도 원자가를 기반으로 공식을 만드는 방법을 가르칩니다. 공식 작성 절차를 단순화하기 위해 이것이 허용된다고 생각합니다. 하지만 위의 이유들로 인해 이것이 전적으로 옳은 것은 아니라는 점을 이해해야 합니다.
보다 보편적인 개념은 산화 상태의 개념입니다. 원자의 산화 상태 값과 원자가 값을 사용하여 화학식을 구성하고 공식 단위를 적을 수 있습니다.
산화 상태- 이것은 입자의 모든 결합이 이온이라는 근사치로 계산된 입자(분자, 이온, 라디칼)의 원자의 조건부 전하입니다.
산화 상태를 결정하기 전에 결합된 원자의 전기 음성도를 비교할 필요가 있습니다. 전기음성도 값이 높은 원자는 음의 산화 상태를 갖고, 전기 음성도가 낮은 원자는 양의 산화 상태를 갖습니다.
산화 상태를 계산할 때 원자의 전기음성도 값을 객관적으로 비교하기 위해 2013년 IUPAC에서는 Allen 척도 사용을 권장했습니다.
* 예를 들어 Allen 규모에 따르면 질소의 전기 음성도는 3.066이고 염소는 2.869입니다.
위의 정의를 예를 들어 설명하겠습니다. 물 분자의 구조식을 작성해 봅시다.
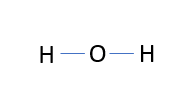
공유 극성 O-H 결합은 파란색으로 표시됩니다.
두 결합이 공유 결합이 아니라 이온 결합이라고 상상해 봅시다. 이온성이라면 전자 하나가 각 수소 원자에서 전기음성도가 더 높은 산소 원자로 이동합니다. 이러한 전환을 파란색 화살표로 표시하겠습니다.
*그 안에는예를 들어, 화살표는 전자의 완전한 전달을 시각적으로 설명하는 역할을 하며 유도 효과를 설명하는 역할을 하는 것이 아닙니다.
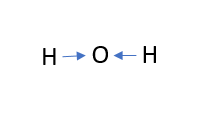
화살표의 개수는 이동된 전자의 수를 나타내고 화살표의 방향은 전자의 이동 방향을 나타냄을 쉽게 알 수 있습니다.
산소 원자를 향한 두 개의 화살표가 있는데, 이는 두 개의 전자가 산소 원자로 전달된다는 것을 의미합니다: 0 + (-2) = -2. 산소 원자에는 -2의 전하가 형성됩니다. 이것은 물 분자에 있는 산소의 산화 상태입니다.
각 수소 원자는 하나의 전자를 잃습니다: 0 - (-1) = +1. 이는 수소 원자의 산화 상태가 +1임을 의미합니다.
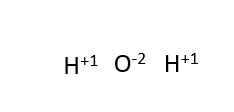
산화 상태의 합은 항상 입자의 총 전하와 같습니다.
예를 들어, 물 분자의 산화 상태의 합은 +1(2) + (-2) = 0과 같습니다. 분자는 전기적으로 중성 입자입니다.
이온의 산화 상태를 계산하면 산화 상태의 합은 그에 따라 전하와 같습니다.
산화 상태 값은 일반적으로 원소 기호의 오른쪽 상단에 표시됩니다. 게다가, 번호 앞에 기호가 적혀 있어요. 숫자 뒤에 기호가 오면 이것이 이온의 전하입니다.
예를 들어, S -2는 산화 상태가 -2인 황 원자이고, S 2-는 -2 전하를 갖는 황 음이온입니다.
S +6 O -2 4 2- - 황산염 음이온의 원자 산화 상태 값 (이온의 전하는 녹색으로 강조 표시됨).
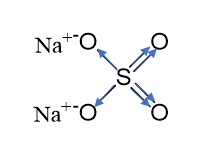
이제 화합물에 혼합 결합(Na 2 SO 4)이 있는 경우를 생각해 보십시오. 황산염 음이온과 나트륨 양이온 사이의 결합은 이온성이며, 황산염 이온의 황 원자와 산소 원자 사이의 결합은 공유 극성입니다. 황산나트륨의 그래픽 공식을 적고 화살표를 사용하여 전자 전이 방향을 나타냅니다.
*구조식은 입자(분자, 이온, 라디칼)의 공유결합 순서를 표시합니다. 구조식은 공유결합이 있는 입자에만 사용됩니다. 이온 결합을 갖는 입자의 경우 구조식의 개념은 의미가 없습니다. 입자에 이온 결합이 포함되어 있으면 그래픽 공식이 사용됩니다.
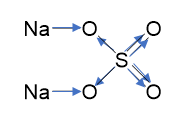
6개의 전자가 중앙 황 원자를 떠나는 것을 볼 수 있습니다. 이는 황의 산화 상태가 0 - (-6) = +6임을 의미합니다.
말단 산소 원자는 각각 두 개의 전자를 취합니다. 이는 산화 상태가 0 + (-2) = -2임을 의미합니다.
가교 산소 원자는 각각 두 개의 전자를 받아들이고 -2의 산화 상태를 갖습니다.
공유 결합이 대시로 표시되고 이온 전하가 표시되는 구조 그래픽 공식을 사용하여 산화 정도를 결정하는 것도 가능합니다.
이 공식에서 가교 산소 원자는 이미 단일 음전하를 갖고 있으며 황 원자 -1 + (-1) = -2에서 추가 전자가 나옵니다. 이는 산화 상태가 -2와 같다는 것을 의미합니다.
나트륨 이온의 산화 정도는 전하와 같습니다. +1.
과산화물 칼륨 (과산화물)의 원소의 산화 상태를 결정합시다. 이를 위해 과산화칼륨에 대한 그래픽 공식을 작성하고 전자의 재분배를 화살표로 표시해 보겠습니다. OO 결합은 공유 비극성 결합이므로 전자의 재분배를 나타내지 않습니다.
* 과산화물 음이온은 라디칼 이온입니다. 한 산소 원자의 형식 전하는 -1이고, 짝을 이루지 않은 전자를 가진 다른 산소 원자는 0입니다.
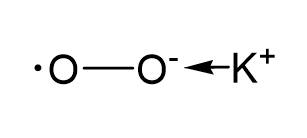
칼륨의 산화 상태가 +1임을 알 수 있습니다. 식에서 칼륨 반대편에 쓰여진 산소 원자의 산화 상태는 -1입니다. 두 번째 산소 원자의 산화 상태는 0입니다.
같은 방식으로 구조 그래픽 공식을 사용하여 산화 정도를 결정할 수 있습니다.
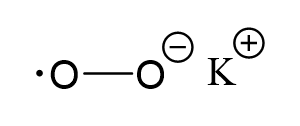
원은 칼륨 이온과 산소 원자 중 하나의 형식 전하를 나타냅니다. 이 경우 형식 전하 값은 산화 상태 값과 일치합니다.
과산화물 음이온의 두 산소 원자는 서로 다른 산화 상태를 갖기 때문에 다음을 계산할 수 있습니다. 산술 평균 산화 상태산소.
이는 / 2 = - 1/2 = -0.5와 같습니다.
산술 평균 산화 상태에 대한 값은 일반적으로 산화 상태의 합이 시스템의 총 전하와 동일함을 보여주기 위해 총 공식 또는 공식 단위로 표시됩니다.
슈퍼옥사이드의 경우: +1 + 2(-0.5) = 0
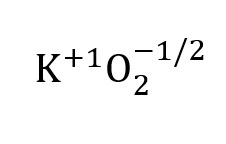
고독한 전자쌍과 공유 결합의 전자가 점으로 표시되는 전자 점 공식을 사용하여 산화 상태를 결정하는 것은 쉽습니다.
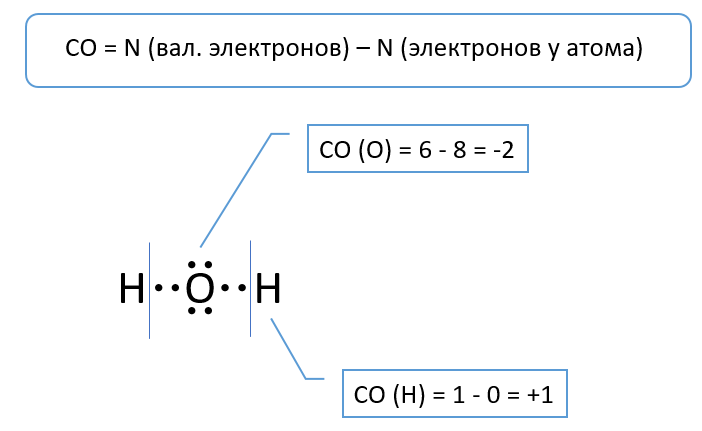
산소는 VIA 족의 원소이므로 원자에는 6 개의 원자가 전자가 있습니다. 물 분자의 결합이 이온성이라고 가정해 봅시다. 이 경우 산소 원자는 한 옥텟의 전자를 받습니다.
이에 따라 산소의 산화 상태는 6 - 8 = -2와 같습니다.
수소 원자: 1 - 0 = +1
그래픽 공식을 사용하여 산화 상태를 결정하는 능력은 이 개념의 본질을 이해하는 데 매우 중요하며, 이 기술은 유기 화학 과정에서도 필요합니다. 무기 물질을 다루는 경우 분자식과 공식 단위를 사용하여 산화 상태를 결정할 수 있어야 합니다.
이를 위해서는 먼저 산화 상태가 일정하고 가변적일 수 있다는 점을 이해해야 합니다. 일정한 산화 상태를 나타내는 원소를 기억해야 합니다.
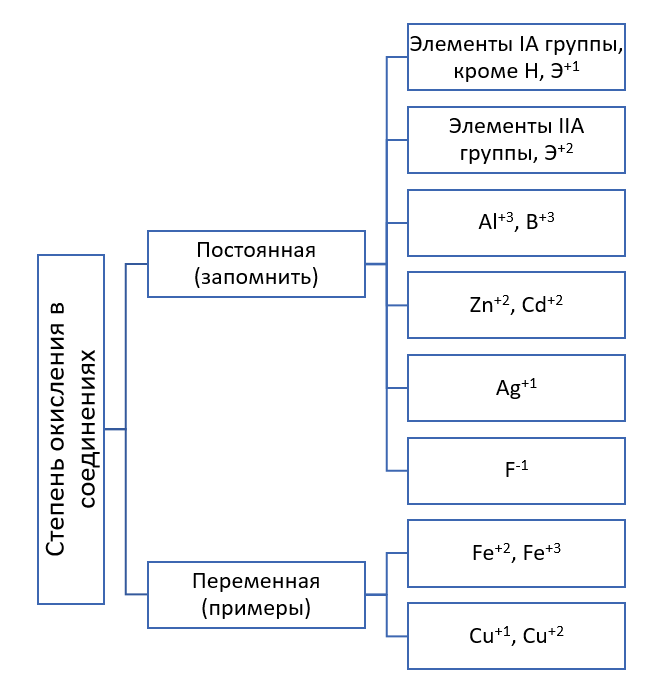
모든 화학 원소는 더 높고 더 낮은 산화 상태를 특징으로 합니다.
최저 산화 상태- 외부 전자층에서 최대 전자 수를 받아 원자가 획득하는 전하입니다.
이를 고려하여, 가장 낮은 산화 상태는 음의 값을 가지며,낮은 전기 음성도 값으로 인해 원자가 전자를 받아들이지 않는 금속을 제외하고. 금속의 산화 상태는 0으로 가장 낮습니다.
주요 하위족의 대부분의 비금속은 외부 전자층을 최대 8개의 전자로 채우려고 시도하며, 그 후 원자는 안정적인 구성을 얻습니다. 옥텟 규칙). 따라서 가장 낮은 산화 상태를 결정하기 위해서는 원자가 옥텟에 도달하기 위해 얼마나 많은 원자가 전자가 부족한지 이해하는 것이 필요합니다.
예를 들어, 질소는 VA족 원소입니다. 이는 질소 원자에 5개의 원자가 전자가 있음을 의미합니다. 질소 원자는 옥텟보다 전자가 3개 부족합니다. 이는 질소의 가장 낮은 산화 상태가 0 + (-3) = -3임을 의미합니다.
