Alapvető kémia: Oxidációs állapot
Számos iskolai tankönyv és kézikönyv megtanítja, hogyan kell vegyértékeken alapuló képleteket létrehozni, még ionos kötésekkel rendelkező vegyületek esetében is. A képletek összeállítási eljárásának egyszerűsítése érdekében véleményünk szerint ez elfogadható. De meg kell értened, hogy ez a fenti okok miatt nem teljesen helyes.
Univerzálisabb fogalom az oxidációs állapot fogalma. Az atomok oxidációs állapotának értékeivel, valamint a vegyértékértékekkel kémiai képleteket állíthat össze és képletegységeket írhat fel.
Oxidációs állapot- ez egy részecskében (molekulában, ionban, gyökben) lévő atom feltételes töltése, amelyet úgy számítunk ki, hogy a részecske minden kötése ionos.
Az oxidációs állapotok meghatározása előtt össze kell hasonlítani a kötött atomok elektronegativitását. A nagyobb elektronegativitású atom negatív oxidációs állapotú, a kisebb elektronegativitású atom pozitív oxidációs állapotú.
Az atomok elektronegativitás értékeinek objektív összehasonlítása érdekében az oxidációs állapotok kiszámításakor az IUPAC 2013-ban az Allen-skála használatát javasolta.
* Tehát például az Allen-skála szerint a nitrogén elektronegativitása 3,066, a klóré pedig 2,869.
Illusztráljuk a fenti definíciót példákkal. Állítsuk össze egy vízmolekula szerkezeti képletét.
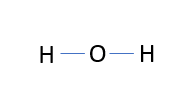
A kovalens poláris O-H kötéseket kék szín jelzi.
Képzeljük el, hogy mindkét kötés nem kovalens, hanem ionos. Ha ionosak lennének, akkor minden hidrogénatomról egy elektron kerülne át az elektronegatívabb oxigénatomra. Jelöljük ezeket az átmeneteket kék nyilakkal.
*AbbanPéldául a nyíl az elektronok teljes átvitelének vizuális szemléltetésére szolgál, nem pedig az induktív hatás szemléltetésére.
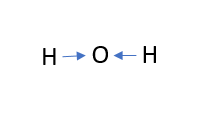
Könnyen észrevehető, hogy a nyilak száma az átvitt elektronok számát mutatja, irányuk pedig az elektronátvitel irányát.
Két nyíl van az oxigénatomra, ami azt jelenti, hogy két elektron kerül át az oxigénatomra: 0 + (-2) = -2. Az oxigénatomon -2 töltés képződik. Ez az oxigén oxidációs állapota egy vízmolekulában.
Minden hidrogénatom veszít egy elektront: 0 - (-1) = +1. Ez azt jelenti, hogy a hidrogénatomok oxidációs állapota +1.
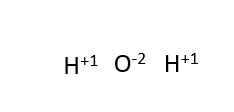
Az oxidációs állapotok összege mindig megegyezik a részecske teljes töltésével.
Például egy vízmolekulában az oxidációs állapotok összege egyenlő: +1(2) + (-2) = 0. A molekula elektromosan semleges részecske.
Ha kiszámítjuk egy ion oxidációs állapotát, akkor az oxidációs állapotok összege ennek megfelelően egyenlő az ion töltésével.
Az oxidációs állapot értéke általában az elemszimbólum jobb felső sarkában van feltüntetve. Ráadásul, a jel a szám elé van írva. Ha a jel a szám után jön, akkor ez az ion töltése.
Például S-2 egy -2 oxidációs állapotú kénatom, S 2- pedig -2 töltésű kén-anion.
S +6 O -2 4 2- - az atomok oxidációs állapotának értékei a szulfát anionban (az ion töltése zölddel van kiemelve).
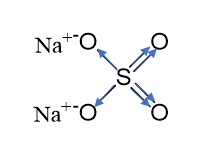
Tekintsük most azt az esetet, amikor a vegyület vegyes kötéseket tartalmaz: Na 2 SO 4. A szulfát-anion és a nátrium-kationok közötti kötés ionos, a szulfátionban a kénatom és az oxigénatomok közötti kötések kovalens polárisak. Írjuk fel a nátrium-szulfát grafikus képletét, és nyilakkal jelezzük az elektronátmenet irányát.
*A szerkezeti képlet a kovalens kötések sorrendjét jeleníti meg egy részecskében (molekula, ion, gyök). A szerkezeti képleteket csak kovalens kötésekkel rendelkező részecskékre használják. Az ionos kötésekkel rendelkező részecskék esetében a szerkezeti képlet fogalmának nincs jelentése. Ha a részecske ionos kötéseket tartalmaz, akkor grafikus képletet használunk.
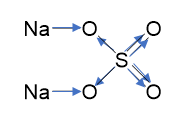
Azt látjuk, hogy hat elektron hagyja el a központi kénatomot, ami azt jelenti, hogy a kén oxidációs állapota 0 - (-6) = +6.
A terminális oxigénatomok mindegyike két elektront vesz fel, ami azt jelenti, hogy oxidációs állapotuk 0 + (-2) = -2
Az áthidaló oxigénatomok mindegyike két elektront fogad be, és oxidációs állapotuk -2.
Az oxidáció mértékét szerkezeti-grafikus képlettel is meg lehet határozni, ahol a kovalens kötéseket szaggatott vonal jelzi, az ionok töltése pedig.
Ebben a képletben az áthidaló oxigénatomok már egyetlen negatív töltéssel rendelkeznek, és a kénatomtól egy további elektron érkezik hozzájuk -1 + (-1) = -2, ami azt jelenti, hogy oxidációs állapotuk -2.
A nátriumionok oxidációs foka megegyezik a töltésükkel, azaz. +1.
Határozzuk meg a kálium-szuperoxidban (szuperoxidban) lévő elemek oxidációs állapotát! Ehhez készítsünk egy grafikus képletet a kálium-szuperoxidra, és mutassuk meg nyíllal az elektronok újraeloszlását. Az O-O kötés kovalens nem poláris kötés, így nem jelzi az elektronok újraeloszlását.
* A szuperoxid anion egy gyökös ion. Az egyik oxigénatom formális töltése -1, a másiké pedig páratlan elektronnal 0.
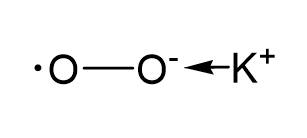
Látjuk, hogy a kálium oxidációs állapota +1. A képletben a káliummal szemben felírt oxigénatom oxidációs állapota -1. A második oxigénatom oxidációs állapota 0.
Ugyanígy az oxidáció mértékét is meghatározhatja a szerkezeti-grafikus képlet segítségével.
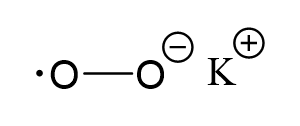
A körök a káliumion és az egyik oxigénatom alaki töltéseit jelzik. Ebben az esetben a formális töltések értékei egybeesnek az oxidációs állapot értékeivel.
Mivel a szuperoxid-anion mindkét oxigénatomja eltérő oxidációs állapotú, ki tudjuk számolni számtani átlag oxidációs állapot oxigén.
Ez egyenlő lesz: / 2 = - 1/2 = -0,5.
Az oxidációs állapotok számtani átlagának értékeit általában bruttó képletekben vagy képletegységekben tüntetik fel annak bizonyítására, hogy az oxidációs állapotok összege megegyezik a rendszer teljes töltésével.
Szuperoxid esetén: +1 + 2(-0,5) = 0
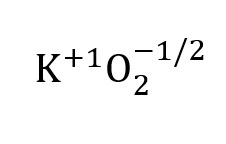
Könnyen meghatározható az oxidációs állapot elektronpont képletekkel, amelyekben a magányos elektronpárokat és a kovalens kötések elektronjait pontok jelölik.
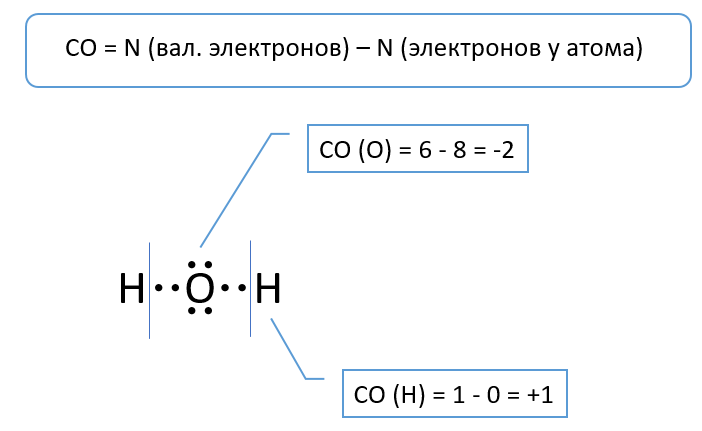
Az oxigén a VIA csoport eleme, ezért atomja 6 vegyértékelektronnal rendelkezik. Képzeljük el, hogy a vízmolekulában a kötések ionosak, ebben az esetben az oxigénatom egy oktett elektront kapna.
Az oxigén oxidációs állapota ennek megfelelően egyenlő: 6 - 8 = -2.
A hidrogénatomok: 1 - 0 = +1
Az oxidációs állapotok grafikus képletek segítségével történő meghatározásának képessége felbecsülhetetlen e fogalom lényegének megértéséhez; erre a készségre a szerves kémia tanfolyamon is szükség lesz. Ha szervetlen anyagokról van szó, akkor az oxidációs állapotokat molekulaképletek és képletegységek segítségével kell tudni meghatározni.
Ehhez először is meg kell értened, hogy az oxidációs állapotok állandóak és változóak lehetnek. Emlékeztetni kell az állandó oxidációs állapotú elemekre.
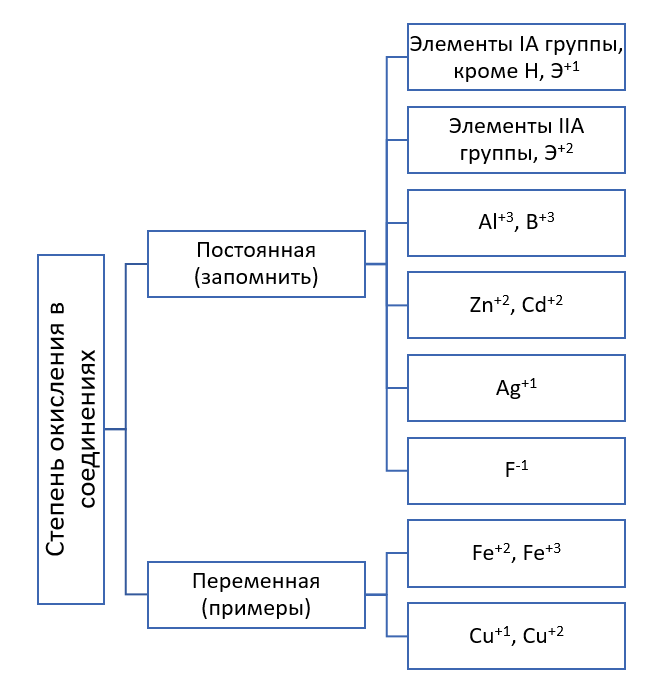
Minden kémiai elemet magasabb és alacsonyabb oxidációs állapot jellemez.
A legalacsonyabb oxidációs állapot- ez az a töltés, amelyet egy atom a külső elektronrétegen a maximális számú elektron befogadása következtében szerez.
Tekintettel erre, a legalacsonyabb oxidációs állapot negatív értékű, a fémek kivételével, amelyek atomjai az alacsony elektronegativitási értékek miatt soha nem fogadnak elektronokat. A fémek legalacsonyabb oxidációs foka 0.
A fő alcsoportok legtöbb nemfémje megpróbálja feltölteni külső elektronrétegét legfeljebb nyolc elektronnal, ami után az atom stabil konfigurációt kap ( oktett szabály). Ezért a legalacsonyabb oxidációs állapot meghatározásához meg kell érteni, hogy hány vegyértékelektron hiányzik egy atomnak az oktett eléréséhez.
Például a nitrogén a VA csoport eleme, ami azt jelenti, hogy a nitrogénatom öt vegyértékelektronnal rendelkezik. A nitrogénatom három elektronnyira van az oktetttől. Ez azt jelenti, hogy a nitrogén legalacsonyabb oxidációs foka: 0 + (-3) = -3
