Число авогадро формула в химии. Химический словарь или справочная тетрадь по химии. Раздел и. общая химия
1. Основные понятия, определения и законы химии
1.3. Химическое количество вещества. Моль. Молярная масса
Химическое количество вещества. Моль. Молярная масса
Характеризуя порцию взятого вещества, используют его массу или объем. Однако с этой же целью можно указать и число структурных единиц во взятой порции вещества. Знать это число чрезвычайно важно, так как в химических реакциях вещества взаимодействуют в отношениях, пропорциональных именно числу структурных единиц, а не массам. Например, запись 2H 2 + O 2 = 2H 2 O обозначает, что числа (но не массы!) реагирующих молекул H 2 и O 2 относятся соответственно как 2 : 1.
Количество вещества является одним из семи базовых количеств, определяемых Международной системой единиц. Фактически это последнее дополнение к списку, которое было добавлено после 14-й Генеральной конференции по весу и мерам, которая состоялась в Согласованной на международном уровне базовой единице для количества вещества, являющегося кротом. Это позже нашло свой путь на английский язык как моль.
Слово «вещество» может иметь несколько значений, в зависимости от контекста, в котором он используется. Поэтому, прежде чем говорить о том, как измеряется вещество, было бы полезно точно определить, что мы имеем в виду, когда говорим о субстанции в контексте физики - или в более широком контексте науки в целом. Для целей следующего обсуждения мы будем использовать слово «вещество» для описания материи, которая имеет определенный состав и конкретные свойства.
Для удобства подсчета числа структурных единиц, содержание которых в любой измеримой порции вещества огромно, была введена новая физическая величина - количество вещества, которую при химических расчетах называют также химическим количеством вещества.
Химическое количество вещества - физическая величина, пропорциональная числу структурных единиц (атомов, молекул, ФЕ), содержащихся в данной порции вещества.
По существу, вещество представляет собой любой чистый элемент или любое чистое соединение. Медь - это чистый металлический элемент и, следовательно, вещество. Диоксид серы является чистым химическим соединением. Таким образом, двуокись серы также является веществом. Соленая вода - раствор соли в воде - не вещество. Это смесь двух веществ - соли и воды. Состав раствора соленой воды не фиксируется, так как отношение соли к воде может значительно варьироваться.
Атомы, молекулы, ионы и другие частицы или группы частиц - все вместе известные как элементарные сущности - являются строительными блоками материи. Даже небольшое количество вещества состоит из почти невообразимо большого числа этих элементарных образований. Они настолько малы, что мы не можем их видеть даже под микроскопом. Очевидно, что они не такие вещи, которые мы можем легко измерить или подсчитать. Однако существуют другие характеристики материи, которые мы можем измерить, и Например, масса, объем, температура и давление.
Обозначается химическое количество буквой n (реже ν).
Единицей химического количества вещества является моль.
Моль - порция вещества, содержащая столько его элементарных структурных единиц, сколько атомов содержится в порции нуклида С-12 массой 12 г.
Число атомов в указанной порции нуклида С-12 примерно равно 6,02 ⋅ 10 23 . Физическая величина, равная 6,02 ⋅ 10 23 моль −1 , называется постоянной Авогадро и обозначается N A:
Моль предоставляет нам удобный способ связать эти количества с определенным количеством элементарных объектов. Если мы знаем массу образца, мы можем рассчитать, сколько молей вещества оно представляет. С помощью этой информации мы можем определить, сколько элементарных объектов она содержит с разумной степенью точности. Это важно во многих отраслях науки, но это особенно важно в химии. Другими словами, кроты помогают нам максимизировать эффективность конверсии химического процесса. По существу, моль дает нам удобный способ подсчета большого количества вещей, будь то атомы, молекулы, электроны или желе.
N A = 6,02 ⋅ 10 23 моль − 1 = 6,02 ⋅ 10 23 моль − 1 .
Единицу числителя в величине N A не указывают, так как для разных случаев она может быть разная, например:
N A = 6,02 ⋅ 10 23 атомов моль,
N A = 6,02 ⋅ 10 23 молекул моль,
N A = 6,02 ⋅ 10 23 ФЕ моль.
Физический смысл постоянной Авогадро состоит в том, что ее численное значение (6,02 ⋅ 10 23) показывает число структурных единиц в 1 моль вещества. Например, 1 моль натрия (m = 23 г) содержит 6,02 ⋅ 10 23 атомов Na; 1 моль серной кислоты (m = 98 г) содержит 6,02 ⋅ 10 23 молекул H 2 SO 4 ; 1 моль карбоната кальция (m = 100 г) содержит 6,02 ⋅ 10 23 формульных единиц CaCO 3 .
В этом смысле это немного похоже на «дюжину». Как вам, несомненно, известно, дюжина означает двенадцать вещей. Например, у нас может быть дюжина яиц, дюжина кроликов или дюжина десантных десантных кораблей. есть что-то моль, это означает, что у нас есть 022 × 10 23 того, что что-то есть. Если вы напишете это полностью, это выглядит так.
Фактически мы округлили значение до трех значимых цифр, чтобы сохранить порядок вещей, но, надеюсь, вы получите эту идею. Это говорит о том, насколько велика цифра - и как маленькие атомы должны быть, если их так много в двенадцати граммах углерода, - это примерно так же, как масса двух нагроможденных чайных ложек сахара. Количество вещества, с которым мы имеем дело в конкретной ситуации, может быть определено как количество элементарных сущностей. Элементарная сущность может быть атомом, молекулой, ионом, электроном или какой-либо другой частицей или определенной группой таких частиц.
Моль - это порция вещества, содержащая 6,02 ⋅ 10 23 его структурных единиц
Число структурных единиц вещества N (B) и химическое количество вещества n (B) связаны соотношением
n (B) = N (B) N A , (1.8)
N (B) = n (B)N A . (1.9)
Зная химическое количество любого вещества, можно по его химической формуле рассчитать химическое количество входящих в его состав отдельных атомов.
Вы можете думать о элементарной сущности как о наименьшем количестве вещества, которое может существовать и все же быть идентифицировано как принадлежащее этому веществу - например, одному из атомов меди или одной молекуле двуокиси серы. Зная, с какими именно элементарными сущностями мы имеем дело в данной ситуации, очень важно с стехиометрической точки зрения. Стойхиометрия - это часть науки о химии, которая занимается вычислением относительных количеств химических веществ, которые будут участвовать в конкретной химической реакции.
Закон объёмных отношений газов
Очень важно понять, что, когда мы говорим о количестве вещества, мы берем некоторое количество элементарных сущностей. Также очень важно понять, что, когда мы говорим о количестве вещества, мы должны точно указать, что такое элементарная сущность. Это необходимо для того, чтобы избежать двусмысленности. Кислород - это элемент, поэтому мы можем предположить, что элементарный объект для некоторого количества кислорода будет атомом кислорода. Однако при стандартных температурах и давлении два атома кислорода объединяются, образуя молекулярный кислород, двухатомный газ.
Один моль любого вещества численно содержит такое же химическое количество атомов, сколько их (атомов) содержится в одной молекуле (формульной единице) вещества
Например:
- в составе молекулы Р 4 содержится 4 атома Р, а в составе 1 моль P 4 - 4 моль атомов P;
- в составе формульной единицы Na 3 PO 4 содержится 3 атома Na, 1 атом Р и 4 атома О, а в 1 моль Na 3 PO 4 - 3 моль атомов Na, 1 моль атомов P и 4 моль атомов O.
С увеличением (уменьшением) химического количества вещества пропорционально возрастает (уменьшается) химическое количество входящих в его состав атомов. Например: 0,5 моль Na 3 PO 4 содержит 3 · 0,5 = 1,5 (моль) атомов Na; 5 моль Р 4 содержит 5 · 4 = = 20 (моль) атомов Р.
На самом деле есть семь двухатомных элементов, большинство из которых вы, вероятно, слышали. Это водород, азот, кислород, фтор, хлор, йод и бром. Неоднозначность можно избежать в таких случаях, заменив термин «вещество» на название лица или указав формулу для вещества.
В химическом соединении, таком как метан, связи между атомами называются ковалентными связями. Это по существу означает, что атомы связывают друг с другом, разделяя электроны, потому что это дает им большую стабильность. У атомов водорода есть один электрон, но для стабилизации нужен еще один электрон. Углеродные атомы имеют шесть электронов, но для стабилизации необходимы четыре дополнительных электрона.
Для подобных расчетов можно использовать и так называемые стехиометрические схемы . Принципы составления стехиометрических схем и проведения расчетов показаны на примере K 2 SO 4 химическим количеством 0,3 моль:
x = n (K) = 0,3 ⋅ 2 1 = 0,6 (моль);
y = n (S) = 0,3 ⋅ 1 1 = 0,3 (моль);
z = n (O) = 0,3 ⋅ 4 1 = 1,2 (моль).
Понятие моль применимо ко всем веществам, а понятие молекула - не ко всем, а только к веществам молекулярного строения. Например, оба понятия применимы в отношении воды (вода имеет молекулярное строение), но в случае карбоната кальция (немолекулярное строение) применимо только понятие «моль».
Молекула метана создается, когда четыре атома водорода связаны с одним атомом углерода. Каждый из четырех электронов, принадлежащих атомам водорода, соединен с одним из четырех электронов, принадлежащих атому углерода. Это фактически означает, что каждый атом водорода получает один электрон, а атом углерода получает четыре электрона. Конечным результатом является то, что каждый атом получает дополнительный электрон, необходимый для достижения стабильности, и все довольны.
Кислород, хлор и метан - все это примеры веществ, которые могут существовать в природе как дискретные молекулы. Ковалентные связи, которые образуются между атомами дискретной молекулы, являются сильными, но межмолекулярные силы - силы притяжения и отталкивания между соседними молекулами - относительно слабы. Однако не все химические соединения состоят из дискретных молекул.
Понятие «моль» используется также и в случае ионов, электронов, протонов, нейтронов и химических связей. Например, если N (PO 4 3 −) = 3,01 ⋅ 10 23 , то
n (PO 4 3 −) = 3,01 ⋅ 10 23 / 6,02 ⋅ 10 23 = 0,5 (моль);
N (e) = 1,505 ⋅ 10 22 ,
n (e) = N (e) / N A = 1,505 ⋅ 10 22 / 6,02 ⋅ 10 23 = 0,025 (моль) ;
2 моль молекул Н 2 (Н–Н) содержат 2 моль связей водород - водород, а 3 моль молекул Н 2 О (Н–О–Н) - 6 моль связей Н–О (в каждой молекуле содержится две связи Н–О).
Как и ковалентные связи, некоторые молекулы имеют другой тип связи, называемый ионной связью. Ионное соединение почти всегда происходит между металлом и неметаллическим. В ионной связи электроны полностью переносятся из одного атома в другой, генерируя два противоположно заряженных иона. Металл теряет электроны, чтобы стать положительно заряженным ионом, называемым катионом, в то время как неметалл получает эти электроны, чтобы стать отрицательно заряженным ионами, называемым анионом. Созданные таким образом катионы и анионы связаны друг с другом электростатическим притяжением.
Молярная масса М (В) - физическая величина, равная отношению массы вещества к его химическому количеству:
M (B) = m (B) n (B) . (1.10)
Из выражения (1.10) следуют формулы для расчета массы вещества:
m (B) = n (B) ⋅ M (B) (1.11)
и его химического количества:
n (B) = m (B) M (B) . (1.12)
Поскольку при n (B) = 1 моль численные значения n (B) и M (B) совпадают, часто говорят, что молярная масса - это масса 1 моль вещества. Это, конечно же, неверно, так как совпадают только численные значения этих величин, а их физический смысл и единицы измерения разные.
Одно химическое соединение, с которым вы, несомненно, будете знакомы, - это хлорид натрия, более известный как обычная соль. Хлорид натрия является ионным соединением, поскольку связи между атомами натрия и хлора являются ионными. Хлорид натрия не существует как дискретные молекулы. В твердой форме ионы образуют структуру решетки, в которой каждый ион окружен шестью ионами противоположного заряда, как показано ниже. В водном растворе ионы натрия и ионы хлорида окружены молекулами воды.
Что такое «моль» и как с его помощью находить количество молекул в веществе
Как, тогда, мы укажем «элементарную сущность» для хлорида натрия? Мы заявили выше, что элементарное образование может считаться наименьшим количеством вещества, которое может существовать и все же быть идентифицировано как принадлежащее этому веществу. Когда натрий и хлор взаимодействуют вместе, чтобы стать хлоридом натрия, один атом натрия подает электрон на один атом хлора. Соотношение ионов натрия и хлорида в полученной кристаллической решетке взаимно однозначно. Следовательно, «элементарная сущность» хлорида натрия может состоять из одного иона натрия и одного иона хлорида.
С помощью молярной массы можно легко рассчитать массу молекулы или формульной единицы вещества:
m мол, ФЕ = M (В) N A . (1.13)
Кроме того, молярную массу можно найти по формуле
M (В) = m мол, ФЕ ⋅ N A . (1.14)
Нетрудно показать, что при использовании единицы молярной массы грамм на моль ее численное значение совпадает:
- с A r для простых веществ атомного строения:
A r (O) = 16, M (O) = 16 г моль;
Правила составления ионных уравнений
По этой причине мы склонны относиться к элементарным элементам ионных соединений, таких как хлорид натрия, как формулы, а не молекулы. Ну, мы также отметили, что количество вещества определяется количеством элементарных сущностей вещества, которое у нас есть. Фактически, моль вещества содержит очень определенное количество элементарных сущностей. Это число определяется тем, что называется константой Авогадро, и в настоящее время определяется как.
Вывод формул веществ по массовым долям элементов
С относительной неопределенностью 0 × 10 -8. Каждый атом углерода-12 состоит из шести протонов, шести нейтронов и шести электронов. Причина выбора углерода-12 в значительной степени историческая. Здесь важно отметить, что относительная атомная масса элемента дается в единицах массы, известных как единая единица атомной массы. Единая единая единица атомной массы приблизительно равна массе одного нуклона. Он определяется как одиннадцатый из массы несвязанного нейтрального атома углерода-12.
- M r сложных веществ молекулярного и немолекулярного строения:
M r (H 2 O) = 18, M (H 2 O) = 18 г моль;
M r (KOH) = 56, M (KOH) = 56 г моль.
В самом деле:
M (B) = m мол (В) ⋅ N A = M r (B) ⋅ u ⋅ N A = M r (B) ⋅ 1 N A ⋅ N A = M r (B)
M (В) = m aт ⋅ N A = A r (B) ⋅ u ⋅ N A = A r (B) ⋅ 1 N A ⋅ N A = A r (B) .
Пример 1.5. Масса молекулы вещества равна 7,31 ⋅ 10 −23 г. Рассчитайте молярную массу вещества.
Ну, мы знаем, что моль любого вещества имеет такое же количество элементарных образований, как двенадцать граммов углерода. Мы также знаем, что это число атомов углерода-12 весит двенадцать граммов и что относительная атомная масса одного атома углерода-12 равна что эквивалентно двенадцати единым единицам атомной массы. Предположим теперь, что мы хотим знать массу одного моля какого-либо другого элемента. Для аргументации предположим, что мы хотим знать массу одного моля меди.
Вы могли бы на этом этапе подумать, что если бы мы знали массу одного атома меди, мы могли бы просто умножить это значение на константу Авогадро, чтобы получить массу одного моля меди - и, конечно же, вы были бы правы. Фактически, давайте сделаем этот расчет и посмотрим, что получится. Масса одного атома меди составляет 055 × 10 -22 г, поэтому наш расчет будет следующим.
Решение. Первый способ. Из формулы (1.14) следует:
M (B) = m мол (B) ⋅ N A
M (B) = 7,31 ⋅ 10 − 23 г ⋅ 6,02 ⋅ 10 23 1 моль = 44 г/моль.
Второй способ. Используем формулу (1.5):
M r (B) = m мол (B) u = 7,31 ⋅ 10 − 23 г 1,66 ⋅ 10 − 24 г = 44 ;
M (B) = 44 г/моль.
Ответ : 44 г/моль.
Газовые законы. Смеси газов
Вещества могут находиться в трех агрегатных состояниях: газообразном, жидком и твердом. Жидкое и твердое состояния называются конденсированными . Для большинства веществ агрегатные состояния взаимопереходящие: при нагревании твердое вещество вначале плавится, затем испаряется; при охлаждении газ вначале конденсируется - переходит в жидкое состояние, затем жидкость замерзает (кристаллизуется). Повышение давления и понижение температуры способствуют переходу вещества в конденсированное состояние с меньшим объемом (и наоборот - понижение давления и повышение температуры способствуют переходу вещества в газообразное состояние).
Поэтому наш ответ будет подвержен небольшой ошибке округления, но он достаточно точен для наших целей. Мы просто пытаемся проиллюстрировать точку здесь. Чтобы сделать это, давайте посмотрим на соответствующий раздел периодической таблицы. Медь имеет единую атомную массу 546.
Мы выделили позицию для меди. Для каждой записи в периодической таблице относительная атомная масса для элемента находится под именем элемента. Обратите внимание, что значение, заданное для меди, составляет 546 - почти идентично количеству граммов, которые мы рассчитали для массы моля меди. Оказывается, нам не нужно вообще делать какие-либо вычисления, чтобы найти массу одного моля элемента, такого как медь. Все, что нам нужно сделать, - это обратиться к периодической таблице и получить относительную атомную массу для этого элемента.
Давление газа в закрытом сосуде прямо пропорционально числу его молекул (или химическому количеству)
При переходе вещества из твердого состояния в жидкое, а затем - в газообразное расстояние между частицами последовательно возрастает, и в случае газа это расстояние в сотни раз больше размеров самих молекул. Из этого следует, что объем порции газа определяется не природой газа (размером его молекул), а расстоянием между молекулами (по существу, объем, который занимает газ, это объем свободного пространства между молекулами).
Расстояние между молекулами газа зависит от температуры и давления, а это означает, что при одинаковых внешних условиях расстояние между молекулами различных газов одинаковое.
Отсюда следует положение, известное как закон Авогадро (1811): в равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул
Из закона Авогадро вытекают три следствия.
1. Одинаковое число молекул различных газов при одинаковых давлении и температуре занимают одинаковый объем.
2. При нормальных условиях (н.у.: Т = 273 К или 0 °С, p = 101,3 кПа) объем порции любого газа химическим количеством 1 моль, или молярный объем V m ,
V m = 22,4 дм 3 /моль.
3. Массы одинаковых объемов двух газов относятся как их молярные (относительные молекулярные) массы. Это отношение называется относительной плотностью газа А по газу В и обозначается как D B (A):
m (A) m (B) = D B (A) = M (A) M (B) = M r (A) M r (B) . (1.15)
С использованием V m находят объем и химическое количество газа:
V (B) = n (B) ⋅ V m ; (1.16)
n (B) = V (B)/V m . (1.17)
Формула (1.15) позволяет, зная относительную плотность неизвестного газа Х по известному газу, находить M (M r) неизвестного газа:
M (X) = D B (X) ⋅ M (B). (1.18)
Например, если относительная плотность газа Х по воздуху (М возд = 29 г/моль) равна 1,517, то молярная масса этого газа
M (X) = 29 ⋅ 1,517 = 44 (г/моль).
Относительная плотность - величина безразмерная и не зависит от температуры и давления.
Зная молярную массу газа, можно легко рассчитать плотность ρ газа (в г/дм 3):
ρ (В) = M (В) V m = M (В) 22,4 . (1.19)
Например, для азота
ρ (N 2) = M (N 2) V m = 28 г/моль 22,4 дм 3 /моль = 1,25 г/дм 3 .
По плотности газа находят его молярную массу:
M (В) = ρ(В)V m . (1.20)
Плотность газа зависит от температуры Т и давления Р : с ростом Т и уменьшением Р плотность уменьшается.
Если равны плотности ρ двух газов (ρ 1 = ρ 2), то равны и их молярные (относительные молекулярные) массы, т.е. M 1 = M 2 (и наоборот - если равны молярные массы газов, то равны и их плотности)
В случае газов справедлив также закон объемных отношений Гей-Люссака (1805–1808): в химических реакциях объемы реагирующих и полученных газов относятся как небольшие целые числа, равные их стехиометрическим коэффициентам
Например, для реакции
4NH 3 + 5O 2 = 4NO + 6H 2 O
V (NH 3) V (O 2) = 4 5 ;
V (O 2) V (NO) = 5 4 .
Пример 1.6. Относительная плотность (н.у.) некоторого газа X по аргону равна 1,2. Найдите массу молекулы газа X.
Решение . Используя формулу (1.18), найдем молярную массу газа Х:
M (X) = D Ar (X) ⋅ M (Ar) ,
M (X) = 1,2 ⋅ 40 = 48 г/моль.
По формуле (1.13) рассчитаем массу молекулы газа X:
m мол (X) = M (X) N A = 48 6,02 ⋅ 10 23 = 7,97 ⋅ 10 − 23 (г).
Можно использовать также формулу (1.7):
m мол (X) = M r (X) u = 48 ⋅ 1,66 ⋅ 10 − 24 = 7,97 ⋅ 10 − 23 (г).
Ответ : 7,97 ⋅ 10 −23 г.
Способы собирания газов. Молярная концентрация газа
Рассмотрим лабораторные способы собирания газов. Таких способов два (рис. 1.1).
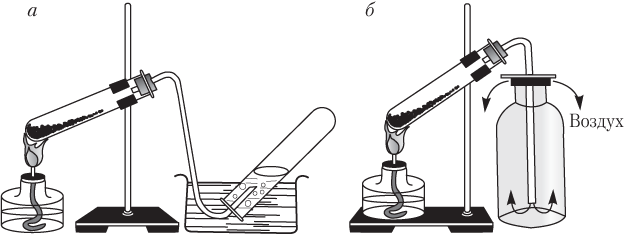
Рис. 1.1. Лабораторные способы собирания кислорода нагреванием KМnO 4:
А - способ вытеснения воды; б - способ вытеснения воздуха
Очевидно, что способом вытеснения воды можно собирать только те газы, которые в воде не растворяются и с ней не взаимодействуют (водород, метан, азот, кислород). Таким способом нельзя собирать газы, которые в воде хорошо растворяются или с ней взаимодействуют (HCl, HBr, HI, HF, NH 3). Оксид углерода(ІV) СО 2 в воде растворяется сравнительно плохо, поэтому его можно собирать данным способом.
При собирании газа способом вытеснения воздуха нужно правильно располагать пробирки:
- горлышком вверх, если газ тяжелее воздуха, т.е. M (газа) > M (возд) . Примеры: CO 2 , SO 2 , HCl;
- горлышком вниз, если газ легче воздуха, т.е. M (газа) < M (возд) . Примеры: H 2 , Ne, NH 3 , CH 4 .
Для характеристики газов используют молярную концентрацию c , равную отношению химического количества газа к объему порции газа:
c (X) = n (X) V (X)
Смеси газов подобно индивидуальным газам характеризуются молярной (относительной молекулярной) массой, плотностью ρ, относительной плотностью D по другому газу, а также массовыми w и объемными φ долями отдельных газов:
M (смеси) = m (смеси) n (смеси) , (1.22)
w = m (газа) m (смеси) , (1.23)
φ = V (газа) V (смеси) , (1.24)
φ = n (газа) n (смеси) , (1.25)
D A (смеси) = M (смеси) M (A) , (1.26)
ρ (смеси) = M (смеси) V m = m (смеси) V (смеси) . (1.27)
Молярную массу смеси газов удобно находить по объемным долям и молярным массам отдельных газов:
M (смеси) = M 1 φ 1 + M 2 φ 2 + M 3 φ 3 + ... + M n φ n . (1.28)
Очевидно:
φ 1 + φ 2 + φ 3 + ... + φ n = 1.
Для смеси двух газов (φ 1 + φ 2 = 1) φ 2 = 1 − φ 1 . Тогда
M (смеси) = M 1 φ 1 + M 2 φ 2 = M 1 φ 1 + M 2 (1 − φ 1) . (1.29)
Пример 1.7. Найдите молярную массу газовой смеси (н.у.), состоящей из азота объемом (н.у.) 1,12 дм 3 и кислорода массой 5,76 г.
Решение . По формулам (1.12) и (1.17) находим химическое количество газов и смеси:
n (O 2) = m (O 2) M (O 2) = 5,76 32 = 0,18 (моль),
n (N 2) = V (N 2) V m = 1,12 22,4 = 0,05 (моль).
Таким образом,
n (смеси) = n (O 2) + n (N 2) = 0,05 + 0,18 = 0,23 (моль).
По формуле (1.25) находим объемные доли газов в смеси:
φ (N 2) = 0,05 0,23 = 0,217 ,
φ (O 2) = 0,18 0,23 = 0,783
или (так как смесь состоит из двух газов):
φ(O 2) = 1 − 0,217 = 0,783.
По формуле (1.29) находим молярную массу смеси:
M (смеси) = M (O 2) φ (O 2) + M (N 2) φ (N 2) ;
M (смеси) = 32 ⋅ 0,783 + 28 ⋅ 0,217 = 31,2 (г/моль).
Ответ : 31,2 г/моль.
1. Молярная масса смеси газов находится между значениями молярной массы самого легкого и самого тяжелого газа смеси. Например, молярная масса смеси NH 3 (M = 17 г/моль) и CO 2 (М = 44 г/моль) в зависимости от объемных долей газов может принимать значения 17 < M (смеси) < 44 (г/моль).
2. Если молярные массы газов в смеси одинаковые, то молярная масса смеси не зависит от объемных долей отдельных газов. Например, молярная масса смеси CO, C 2 H 2 и N 2 всегда равна 28 г/моль независимо от объемных долей компонентов.
3. Если к смеси газов добавляется газ, M которого больше, чем M самого тяжелого газа смеси, то M (смеси) возрастает. Например, если к различным по составу смесям N 2 и O 2 добавлять CO 2 , то M (смеси) возрастет.
4. Если к смеси газов добавляется газ, M которого меньше M самого легкого газа смеси, то M (смеси) смеси уменьшается. Например, если к различным по составу смесям Ne и Ar добавлять He, то M (смеси) уменьшится.
5. При равенстве объемных долей газов в смеси молярная масса смеси равна среднеарифметическому молярных масс отдельных газов. Например, для смеси равных объемов CO 2 и O 2:
M (смеси) = M (O 2) + M (CO 2) 2 = 32 + 44 2 = 38 г/моль.
Инструкция
Зная такую величину, как количество вещества ν, найдите число молекул в нем. Для этого количество вещества, измеренное в молях, умножьте на постоянную Авогадро (NА=6,022∙10^23 1/моль), которая равна числу молекул в 1 моле вещества N=ν/ NА. Например, если имеется 1,2 моль поваренной соли, то в ней содержится N=1,2∙6,022∙10^23 ≈7,2∙10^23 молекул .
Видео по теме
Ни один реальный газ (включая кислород), конечно же, не является идеальным, поэтому уравнение Менделеева-Клапейрона можно использовать для расчетов лишь при условиях, не очень сильно отличающихся от нормальных.
Молекула обладает настолько мизерными размерами, что количество молекул даже в крохотной крупинке или капле какого-либо вещества будет просто грандиозным. Оно не поддается измерению с помощью обычных методов исчисления.
Что такое «моль» и как с его помощью находить количество молекул в веществе
Для определения, сколько молекул находится в том или ином количестве вещества, используется понятие «моль». Моль – это такое количество вещества, в котором находится 6,022*10^23 его молекул (или атомов, или ионов). Эта громадная величина носит название «постоянная Авогадро», она названа в честь знаменитого итальянского ученого. Величина обозначается NA. С помощью постоянной Авогадро можно очень легко определить, сколько молекул содержится в любом количестве молей любого вещества. Например, в 1,5 молях содержится 1,5*NA = 9,033*10^23 молекул. В тех случаях, когда требуется очень высокая точность измерения, необходимо использовать значение числа Авогадро с большим количеством знаков после запятой. Наиболее полная его величина составляет: 6,022 141 29(27)*10^23.
Как можно найти количество молей вещества
Определить, сколько молей содержится в каком-то количестве вещества, очень просто. Для этого нужно только иметь точную формулу вещества и таблицу Менделеева под рукой. Предположим, у вас есть 116 граммов обыкновенной поваренной соли. Вам нужно определить, сколько молей содержится в таком количестве (и, соответственно, сколько там молекул)?
Прежде всего вспомните химическую формулу поваренной соли. Она выглядит следующим образом: NaCl. Молекула этого вещества состоит из двух атомов (точнее, ионов): натрия и хлора. Какова ее молекулярная масса? Она складывается из атомных масс элементов. С помощью таблицы Менделеева вы знаете, что атомная масса натрия приблизительно равна 23, а атомная масса хлора – 35. Следовательно, молекулярная масса этого вещества составляет 23 + 35 = 58. Масса измеряется в атомных единицах массы, где за эталон принят самый легкий атом – водорода.
А зная молекулярную массу вещества, вы тут же сможете определить и ее молярную массу (то есть массу одного моля). Дело в том, что численно молекулярная и молярная масса полностью совпадают, у них только разные единицы измерения. Если молекулярная масса измеряется в атомных единицах, то молярная – в граммах. Следовательно, 1 моль поваренной соли весит приблизительно 58 граммов. А у вас, по условиям задачи, 116 граммов поваренной соли, то есть 116/58 = 2 моля. Умножив 2 на постоянную Авогадро, вы определите, что в 116 граммах хлорида натрия находится примерно 12,044*10^23 молекул, или примерно 1,2044*10^24.
Источники:
- как определить количество молекул
