Fórmula del número de Avogadro en química. Diccionario químico o libro de referencia sobre química. Sección I. química General
1. Conceptos básicos, definiciones y leyes de la química.
1.3. Cantidad química de una sustancia. Mol. Masa molar
Cantidad química de una sustancia. Mol. Masa molar
Al caracterizar una porción de una sustancia ingerida, utilice su masa o volumen. Sin embargo, con el mismo propósito, también se puede indicar el número de unidades estructurales en una porción extraída de una sustancia. Conocer este número es extremadamente importante porque reacciones químicas Las sustancias interactúan en relaciones proporcionales precisamente al número de unidades estructurales, y no a las masas. Por ejemplo, la notación 2H 2 + O 2 = 2H 2 O significa que los números (¡pero no las masas!) de las moléculas que reaccionan H 2 y O 2 están relacionados como 2: 1, respectivamente.
La cantidad de una sustancia es una de las siete cantidades básicas definidas Sistema internacional unidades. De hecho, esta es la última incorporación a la lista, que se agregó después de la 14ª Conferencia General de Pesos y Medidas, que tuvo lugar en la Unidad Básica Internacionalmente Armonizada para la cantidad de una sustancia que es mol. Esto más tarde encontró su camino hacia idioma en Inglés como una polilla.
La palabra "sustancia" puede tener varios significados, según el contexto en el que se utilice. Así que antes de hablar de cómo se mide la materia, podría resultar útil definir exactamente a qué nos referimos cuando hablamos de sustancia en el contexto de la física, o en el contexto más amplio de la ciencia en general. Para los propósitos de la siguiente discusión, usaremos la palabra "materia" para describir la materia que tiene una composición específica y propiedades específicas.
Para facilitar el cálculo del número de unidades estructurales, cuyo contenido en cualquier porción mensurable de una sustancia es enorme, se introdujo una nueva cantidad física: la cantidad de una sustancia, que en los cálculos químicos también se denomina cantidad química de sustancia.
Cantidad química de una sustancia.- una cantidad física proporcional al número de unidades estructurales (átomos, moléculas, unidades físicas) contenidas en una porción determinada de una sustancia.
Esencialmente, una sustancia es cualquier elemento puro o cualquier compuesto puro. El cobre es un elemento metálico puro y, por tanto, una sustancia. El dióxido de azufre es un compuesto químico puro. Por tanto, el dióxido de azufre también es una sustancia. Agua salada- una solución de sal en agua no es una sustancia. Es una mezcla de dos sustancias: sal y agua. La composición de la solución de agua salada no es fija, ya que la proporción entre sal y agua puede variar significativamente.
Los átomos, moléculas, iones y otras partículas o grupos de partículas, conocidos colectivamente como entidades elementales, son los componentes básicos de la materia. Incluso una pequeña cantidad de materia está compuesta de cantidades casi inimaginables. gran número estas formaciones elementales. Son tan pequeños que no podemos verlos ni siquiera con un microscopio. Evidentemente, no son cosas que podamos medir o contar fácilmente. Sin embargo, hay otras características de la materia que podemos medir, como la masa, el volumen, la temperatura y la presión.
La cantidad química se designa con la letra n (menos comúnmente ν).
La unidad de cantidad química de una sustancia es el mol.
Un mol es una porción de una sustancia que contiene tantas unidades estructurales elementales como átomos contiene una porción de nucleido C-12 que pesa 12 g.
El número de átomos en la porción indicada del nucleido C-12 es aproximadamente 6,02 ⋅ 10 23. Una cantidad física igual a 6,02 ⋅ 10 23 mol −1 se llama la constante de avogadro y se denota por N A:
El mol nos proporciona una manera conveniente de asociar estas cantidades con un cierto número de objetos elementales. Si conocemos la masa de una muestra, podemos calcular cuántos moles de sustancia representa. Con esta información podemos determinar cuántos objetos elementales contiene con un grado razonable de precisión. Esto es importante en muchas ramas de la ciencia, pero es especialmente importante en la química. En otras palabras, los moles nos ayudan a maximizar la eficiencia de conversión de un proceso químico. Básicamente, el mol nos brinda una manera conveniente de contar una gran cantidad de cosas, ya sean átomos, moléculas, electrones o gelatinas.
norte UN = 6,02 ⋅ 10 23 mol - 1 = 6,02 ⋅ 10 23 mol - 1 .
No se indica la unidad del numerador en el valor N A, ya que para diferentes casos puede ser diferente, por ejemplo:
N A = 6,02 ⋅ 10 23 átomos mol,
N A = 6,02 ⋅ 10 23 moléculas mol,
N A = 6,02 ⋅ 10 23 FU mol.
El significado físico de la constante de Avogadro es que su valor numérico (6,02 ⋅ 10 23) muestra el número de unidades estructurales en 1 mol de una sustancia. Por ejemplo, 1 mol de sodio (m = 23 g) contiene 6,02 ⋅ 10 23 átomos de Na; 1 mol de ácido sulfúrico (m = 98 g) contiene 6,02 ⋅ 10 23 moléculas de H 2 SO 4; 1 mol de carbonato de calcio (m = 100 g) contiene 6,02 ⋅ 10 23 unidades fórmula de CaCO 3.
En ese sentido es un poco como "una docena". Como sin duda sabrás, una docena significa doce cosas. Por ejemplo, podríamos tener una docena de huevos, una docena de conejos o una docena de lanchas de desembarco. hay algo mole, esto quiere decir que tenemos 022×10 23 de lo que es algo. Si lo escribes completo, se verá así.
De hecho, hemos redondeado el valor a tres cifras significativas para mantener el orden, pero esperamos que entiendas la idea. Esto indica el tamaño de la figura (y lo pequeños que deben ser los átomos si hay tantos en doce gramos de carbono), que es aproximadamente lo mismo que la masa de dos cucharaditas colmadas de azúcar. La cantidad de materia con la que nos enfrentamos en una situación particular se puede definir como el número de entidades elementales. Una entidad elemental puede ser un átomo, molécula, ion, electrón o alguna otra partícula o grupo específico de dichas partículas.
Un mol es una porción de una sustancia que contiene 6,02 ⋅ 10 23 de sus unidades estructurales.
El número de unidades estructurales de una sustancia N (B) y la cantidad química de una sustancia n (B) están relacionados por la relación
n (B) = N (B) N A , (1.8)
N (B) = n (B)N A . (1.9)
Conociendo la cantidad química de cualquier sustancia, puedes utilizar su fórmula química para calcular la cantidad química de los átomos individuales incluidos en su composición.
Se puede pensar en una entidad elemental como la cantidad más pequeña de una sustancia que puede existir y aún identificarse como perteneciente a esa sustancia; por ejemplo, uno de los átomos de cobre o una molécula de dióxido de azufre. Saber exactamente con qué entidades elementales estamos tratando en una situación determinada es muy importante desde el punto de vista estequiométrico. La estequiometría es una rama de la ciencia de la química que se ocupa del cálculo de las cantidades relativas de sustancias químicas que participarán en una reacción química particular.
Ley de proporciones volumétricas de gases.
Es muy importante entender que cuando hablamos de cantidad de materia, tomamos un cierto número de entidades elementales. También es muy importante entender que cuando hablamos de la cantidad de una sustancia, debemos especificar exactamente cuál es la esencia elemental. Esto es necesario para evitar ambigüedades. El oxígeno es un elemento, por lo que podemos suponer que el objeto elemental para una cierta cantidad de oxígeno sería un átomo de oxígeno. Sin embargo, a temperaturas y presiones estándar, dos átomos de oxígeno se combinan para formar oxígeno molecular, un gas diatómico.
Un mol de cualquier sustancia contiene el mismo número químico de átomos que hay en una molécula (unidad fórmula) de la sustancia.
Por ejemplo:
- la molécula de P4 contiene 4 átomos de P y 1 mol de P4 contiene 4 moles de átomos de P;
- la unidad de fórmula Na 3 PO 4 contiene 3 átomos de Na, 1 átomo de P y 4 átomos de O, y 1 mol de Na 3 PO 4 contiene 3 moles de átomos de Na, 1 mol de átomos de P y 4 moles de átomos de O.
Con un aumento (disminución) en la cantidad química de una sustancia, la cantidad química de sus átomos constituyentes aumenta (disminuye) proporcionalmente. Por ejemplo: 0,5 mol Na 3 PO 4 contiene 3 · 0,5 = 1,5 (mol) átomos de Na; 5 moles de P4 contienen 5 4 = 20 (moles) átomos de P.
En realidad, hay siete elementos diatómicos, de los cuales probablemente hayas oído hablar de la mayoría. Estos son hidrógeno, nitrógeno, oxígeno, flúor, cloro, yodo y bromo. En tales casos se puede evitar la ambigüedad sustituyendo el término “sustancia” por el nombre de la persona o proporcionando la fórmula de la sustancia.
En un compuesto químico como el metano, los enlaces entre los átomos se denominan enlaces covalentes. Básicamente, esto significa que los átomos se unen compartiendo electrones porque esto les da una mayor estabilidad. Los átomos de hidrógeno tienen un electrón, pero necesitan otro electrón para estabilizarse. Los átomos de carbono tienen seis electrones, pero requieren cuatro electrones adicionales para estabilizarse.
Para tales cálculos, puede utilizar el llamado esquemas estequiométricos. Los principios para elaborar esquemas estequiométricos y realizar cálculos se muestran en el ejemplo de K 2 SO 4 con una cantidad química de 0,3 mol:
x = n (K) = 0,3 ⋅ 2 1 = 0,6 (mol);
y = norte (S) = 0,3 ⋅ 1 1 = 0,3 (mol);
z = norte (O) = 0,3 ⋅ 4 1 = 1,2 (mol).
El concepto de mol es aplicable a todas las sustancias, pero el concepto de molécula no es aplicable a todas, sino solo a las sustancias con estructura molecular. Por ejemplo, ambos conceptos son aplicables en el caso del agua (el agua tiene una estructura molecular), pero en el caso del carbonato de calcio (estructura no molecular), solo es aplicable el concepto “mol”.
La molécula de metano se crea cuando cuatro átomos de hidrógeno se unen a un átomo de carbono. Cada uno de los cuatro electrones que pertenecen a los átomos de hidrógeno está conectado a uno de los cuatro electrones que pertenecen al átomo de carbono. Esto significa efectivamente que cada átomo de hidrógeno recibe un electrón y el átomo de carbono recibe cuatro electrones. El resultado final es que cada átomo obtiene el electrón adicional que necesita para lograr estabilidad y todos están contentos.
El oxígeno, el cloro y el metano son ejemplos de sustancias que pueden existir en la naturaleza como moléculas discretas. Los enlaces covalentes que se forman entre los átomos de una molécula discreta son fuertes, pero las fuerzas intermoleculares (las fuerzas de atracción y repulsión entre moléculas vecinas) son relativamente débiles. Sin embargo, no todos los compuestos químicos están compuestos de moléculas discretas.
El concepto de “mol” también se utiliza en el caso de iones, electrones, protones, neutrones y enlaces químicos. Por ejemplo, si N (PO 4 3 −) = 3,01 ⋅ 10 23, entonces
norte (PO 4 3 −) = 3,01 ⋅ 10 23 / 6,02 ⋅ 10 23 = 0,5 (mol);
norte(mi) = 1,505 ⋅ 10 22,
n (e) = N (e) / N A = 1,505 ⋅ 10 22 / 6,02 ⋅ 10 23 = 0,025 (mol);
2 moles de moléculas de H2 (H – H) contienen 2 moles de enlaces hidrógeno-hidrógeno, y 3 moles de moléculas de H2O (H – O – H) contienen 6 moles de enlaces H – O (cada molécula contiene dos enlaces H – O) .
Al igual que los enlaces covalentes, algunas moléculas tienen otro tipo de enlace llamado enlace iónico. El enlace iónico casi siempre ocurre entre un metal y un no metal. En un enlace iónico, los electrones se transfieren completamente de un átomo a otro, generando dos iones con cargas opuestas. Un metal pierde electrones para convertirse en un ion con carga positiva llamado catión, mientras que un no metal gana esos electrones para convertirse en un ion con carga negativa llamado anión. Los cationes y aniones así formados están unidos entre sí mediante atracción electrostática.
La masa molar M (B) es una cantidad física igual a la relación entre la masa de una sustancia y su cantidad química:
METRO (B) = metro (B) norte (B) . (1.10)
De la expresión (1.10) se siguen las fórmulas para calcular la masa de una sustancia:
metro (B) = norte (B) ⋅ M (B) (1.11)
y su cantidad química:
norte (B) = m (B) M (B) . (1.12)
Dado que en n(B) = 1 mol los valores numéricos de n(B) y M(B) son iguales, a menudo se dice que la masa molar es la masa de 1 mol de una sustancia. Esto, por supuesto, es incorrecto, ya que solo coinciden los valores numéricos de estas cantidades, pero su significado físico y unidades de medida son diferentes.
Un compuesto químico que sin duda conocerás es el cloruro de sodio, más conocido como sal común. El cloruro de sodio es un compuesto iónico porque los enlaces entre los átomos de sodio y cloro son iónicos. El cloruro de sodio no existe como moléculas discretas. En forma sólida, los iones forman una estructura reticular en la que cada ion está rodeado por seis iones de carga opuesta, como se muestra a continuación. En una solución acuosa, los iones de sodio y los iones de cloruro están rodeados por moléculas de agua.
¿Qué es un “mol” y cómo usarlo para encontrar la cantidad de moléculas en una sustancia?
Entonces, ¿cómo indicamos la "esencia elemental" del cloruro de sodio? Dijimos anteriormente que una formación elemental puede considerarse la cantidad más pequeña de una sustancia que puede existir y, sin embargo, identificarse como perteneciente a esa sustancia. Cuando el sodio y el cloro reaccionan juntos para convertirse en cloruro de sodio, un átomo de sodio suministra un electrón a un átomo de cloro. La proporción de iones de sodio y cloruro en la red cristalina resultante es de uno a uno. Por tanto, la "esencia elemental" del cloruro de sodio puede consistir en un ion sodio y un ion cloruro.
Usando la masa molar, puedes calcular fácilmente la masa de una molécula o unidad fórmula de una sustancia:
m mol, FE = M (B) N A. (1.13)
Además, la masa molar se puede encontrar usando la fórmula
M (B) = m mol, FE ⋅ N A. (1.14)
Es fácil demostrar que cuando se utiliza la unidad de masa molar gramo por mol, su valor numérico es el mismo:
- con A r para sustancias simples de estructura atómica:
Ar (O) = 16, M (O) = 16 g mol;
Reglas para componer ecuaciones iónicas.
Por esta razón, tendemos a tratar los elementos elementales de los compuestos iónicos como el cloruro de sodio como fórmulas en lugar de moléculas. Bueno, también notamos que la cantidad de materia está determinada por la cantidad de entidades elementales de materia que tenemos. De hecho, un mol de sustancia contiene un número muy específico de entidades elementales. Este número está definido por lo que se llama constante de Avogadro, y actualmente se define como.
Derivación de fórmulas de sustancias por fracciones masivas de elementos.
Con una incertidumbre relativa de 0 × 10 -8. Cada átomo de carbono 12 consta de seis protones, seis neutrones y seis electrones. La razón para elegir el carbono 12 es en gran medida histórica. Es importante señalar aquí que la masa atómica relativa de un elemento se da en unidades de masa conocidas como unidad de masa atómica unificada. Una sola unidad de masa atómica es aproximadamente igual a la masa de un nucleón. Se define como la undécima parte de la masa del átomo de carbono 12 neutro no enlazado.
- M r de sustancias complejas de estructura molecular y no molecular:
Mr (H2O) = 18, M(H2O) = 18 g mol;
Mr (KOH) = 56, M (KOH) = 56 g mol.
En efecto:
M (B) = m mol (B) ⋅ N A = M r (B) ⋅ u ⋅ N A = M r (B) ⋅ 1 N A ⋅ N A = M r (B)
M (B) = m en ⋅ N A = A r (B) ⋅ u ⋅ N A = A r (B) ⋅ 1 N A ⋅ N A = A r (B) .
Ejemplo 1.5. La masa de una molécula de sustancia es 7,31 ⋅ 10 −23 g. Calcula la masa molar de la sustancia.
Pues sabemos que un mol de cualquier sustancia tiene la misma cantidad de formaciones elementales que doce gramos de carbono. También sabemos que este número de átomos de carbono 12 pesa doce gramos y que la masa atómica relativa de un átomo de carbono 12 es igual a doce unidades de masa atómica única. Supongamos ahora que queremos saber la masa de un mol de algún otro elemento. A efectos de argumentación, supongamos que queremos saber la masa de un mol de cobre.
En este punto, podría estar pensando que si supiéramos la masa de un átomo de cobre, simplemente podríamos multiplicar ese valor por la constante de Avogadro para obtener la masa de un mol de cobre y, por supuesto, estaría en lo cierto. De hecho, hagamos este cálculo y veamos qué sucede. La masa de un átomo de cobre es 055 × 10 -22 g, por lo que nuestro cálculo será el siguiente.
Solución. Primera manera. De la fórmula (1.14) se deduce:
M (B) = m mol (B) ⋅ norte A
M (B) = 7,31 ⋅ 10 − 23 g ⋅ 6,02 ⋅ 10 23 1 mol = 44 g/mol.
Segunda vía. Usamos la fórmula (1.5):
M r (B) = m mol (B) u = 7,31 ⋅ 10 − 23 g 1,66 ⋅ 10 − 24 g = 44 ;
M(B) = 44 g/mol.
Respuesta: 44 g/mol.
Leyes de los gases. Mezclas de gases
Las sustancias pueden encontrarse en tres estados de agregación: gaseoso, líquido y sólido. Los estados líquido y sólido se llaman condensado. Para la mayoría de las sustancias estados de agregación interconvertible: cuando se calienta, el sólido primero se funde y luego se evapora; Cuando se enfría, el gas primero se condensa, pasa a un estado líquido y luego el líquido se congela (cristaliza). Un aumento de presión y una disminución de la temperatura contribuyen a la transición de una sustancia a un estado condensado con un volumen menor (y viceversa: una disminución de la presión y un aumento de temperatura contribuyen a la transición de una sustancia a un estado gaseoso) .
Por lo tanto, nuestra respuesta estará sujeta a un pequeño error de redondeo, pero es lo suficientemente precisa para nuestros propósitos. Sólo estamos tratando de ilustrar un punto aquí. Para hacer esto, veamos la sección correspondiente de la tabla periódica. El cobre tiene una única masa atómica de 546.
Hemos asignado una posición para el cobre. Para cada entrada en la tabla periódica, la masa atómica relativa del elemento se encuentra debajo del nombre del elemento. Tenga en cuenta que el valor dado para el cobre es 546, casi idéntico al número de gramos que calculamos para la masa de un mol de cobre. Resulta que no necesitamos hacer ningún cálculo para encontrar la masa de un mol de un elemento como el cobre. Todo lo que tenemos que hacer es consultar la tabla periódica y obtener la masa atómica relativa de ese elemento.
La presión de un gas en un recipiente cerrado es directamente proporcional al número de sus moléculas (o cantidad química)
Cuando una sustancia pasa de de Estado sólido En estado líquido y luego en estado gaseoso, la distancia entre las partículas aumenta sucesivamente y, en el caso de un gas, esta distancia es cientos de veces mayor que el tamaño de las moléculas mismas. De esto se deduce que el volumen de una porción de gas no está determinado por la naturaleza del gas (el tamaño de sus moléculas), sino por la distancia entre las moléculas (esencialmente, el volumen que ocupa un gas es el volumen de espacio libre entre las moléculas).
La distancia entre las moléculas de un gas depende de la temperatura y la presión, lo que significa que en las mismas condiciones externas, la distancia entre las moléculas de diferentes gases es la misma.
Esto implica una proposición conocida como ley de Avogadro (1811): volúmenes iguales de diferentes gases en las mismas condiciones contienen el mismo número de moléculas.
De la ley de Avogadro se derivan tres consecuencias.
1. El mismo número de moléculas de diferentes gases a la misma presión y temperatura ocupan el mismo volumen.
2. En condiciones normales (norma: T = 273 K o 0 °C, p = 101,3 kPa), el volumen de una porción de cualquier gas con una cantidad química de 1 mol, o volumen molar V m,
Vm = 22,4 dm3/mol.
3. Las masas de volúmenes iguales de dos gases están relacionadas como sus masas molares (moleculares relativas). Esta relación se llama densidad relativa del gas A al gas B y se denota como D B (A):
m (A) m (B) = D B (A) = M (A) M (B) = M r (A) M r (B) . (1.15)
Usando V m, se encuentran el volumen y la cantidad química del gas:
V (B) = norte (B) ⋅ V m ; (1.16)
norte (B) = V (B)/V metro. (1.17)
La fórmula (1.15) permite, conociendo la densidad relativa del gas desconocido X a partir del gas conocido, encontrar M (M r) del gas desconocido:
M (X) = D B (X) ⋅ M (B). (1.18)
Por ejemplo, si la densidad relativa del gas X en el aire (M aire = 29 g/mol) es 1,517, entonces la masa molar de este gas
M(X) = 29 ⋅ 1,517 = 44 (g/mol).
La densidad relativa es una cantidad adimensional y no depende de la temperatura ni de la presión.
Conociendo la masa molar del gas, se puede calcular fácilmente la densidad ρ del gas (en g/dm 3):
ρ (V) = M (V) V m = M (V) 22.4. (1.19)
Por ejemplo, para el nitrógeno
ρ (N 2) = M (N 2) V m = 28 g/mol 22,4 dm 3 /mol = 1,25 g/dm 3.
Con base en la densidad de un gas, su masa molar se encuentra:
METRO (B) = ρ(B)V metro . (1.20)
La densidad de un gas depende de la temperatura T y la presión P: al aumentar T y disminuir P, la densidad disminuye.
Si las densidades ρ de dos gases son iguales (ρ 1 = ρ 2), entonces sus masas molares (moleculares relativas) también son iguales, es decir M 1 = M 2 (y viceversa: si las masas molares de los gases son iguales, entonces sus densidades son iguales)
En el caso de los gases también es cierto Ley de relaciones volumétricas de Gay-Lussac(1805-1808): en las reacciones químicas, los volúmenes de los gases reaccionantes y resultantes se relacionan como números enteros pequeños iguales a sus coeficientes estequiométricos.
Por ejemplo, para la reacción
4NH3 + 5O2 = 4NO + 6H2O
V (NH 3) V (O 2) = 4 5;
V (O 2) V (NO) = 5 4.
Ejemplo 1.6. La densidad relativa (r.s.) de algo de gas X en argón es 1,2. Encuentre la masa de una molécula de gas X.
Solución . Usando la fórmula (1.18), encontramos la masa molar del gas X:
M (X) = D Ar (X) ⋅ M (Ar) ,
METRO(X) = 1,2 ⋅ 40 = 48 g/mol.
Usando la fórmula (1.13), calculamos la masa de una molécula de gas X:
m mol (X) = M (X) N A = 48 6,02 ⋅ 10 23 = 7,97 ⋅ 10 − 23 (g).
También puedes utilizar la fórmula (1.7):
m mol (X) = M r (X) u = 48 ⋅ 1,66 ⋅ 10 − 24 = 7,97 ⋅ 10 − 23 (g).
Respuesta: 7,97 ⋅ 10 −23 g.
Métodos de recogida de gases. Concentración molar de gas
Consideremos métodos de laboratorio para recolectar gases. Existen dos métodos de este tipo (Fig. 1.1).
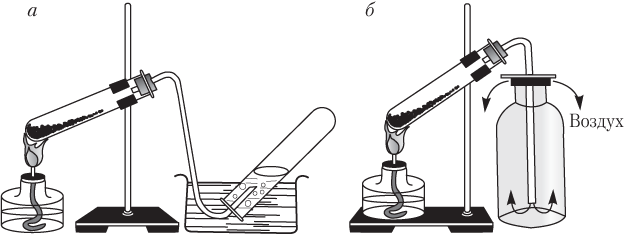
Arroz. 1.1. Métodos de laboratorio para recolectar oxígeno calentando KMnO 4:
A - método de desplazamiento del agua; b - método de desplazamiento del aire
Es obvio que método para desplazar el agua Solo se pueden recolectar aquellos gases que no se disuelven en agua y no interactúan con ella (hidrógeno, metano, nitrógeno, oxígeno). Este método no se puede utilizar para recolectar gases que se disuelven bien en agua o interactúan con ella (HCl, HBr, HI, HF, NH 3). El monóxido de carbono (IV) CO 2 es relativamente poco soluble en agua, por lo que se puede recolectar mediante este método.
Al recolectar gas método de desplazamiento de aire Es necesario colocar los tubos correctamente:
- cuello hacia arriba si el gas es más pesado que el aire, es decir, M (gas) > M (aire). Ejemplos: CO2, SO2, HCl;
- cuello hacia abajo, si el gas es más ligero que el aire, es decir M (gas)< M (возд) . Примеры: H 2 , Ne, NH 3 , CH 4 .
Para características del gas usar concentración molar c, igual a la relación entre la cantidad química de gas y el volumen de una porción de gas:
c (X) = n (X) V (X)
Las mezclas de gases, como los gases individuales, se caracterizan por la masa molar (molecular relativa), la densidad ρ, la densidad relativa D de otro gas, así como la masa w y las fracciones de volumen φ de los gases individuales:
M (mezclas) = m (mezclas) n (mezclas), (1.22)
w = m (gas) m (mezcla), (1.23)
φ = V (gas) V (mezcla), (1.24)
φ = n (gas) n (mezcla), (1.25)
D A (mezclas) = M (mezclas) M (A), (1.26)
ρ (mezclas) = M (mezclas) V m = m (mezclas) V (mezclas) . (1.27)
Es conveniente encontrar la masa molar de una mezcla de gases a partir de las fracciones de volumen y masas molares de gases individuales:
M (mezclas) = M 1 φ 1 + M 2 φ 2 + M 3 φ 3 + ... + M n φ n. (1.28)
Obviamente:
φ 1 + φ 2 + φ 3 + ... + φ norte = 1.
Para una mezcla de dos gases (φ 1 + φ 2 = 1) φ 2 = 1 − φ 1. Entonces
M (mezclas) = M 1 φ 1 + M 2 φ 2 = M 1 φ 1 + M 2 (1 − φ 1) . (1.29)
Ejemplo 1.7. Encuentre la masa molar de una mezcla de gases (n.s.) que consta de nitrógeno con un volumen (n.s.) de 1,12 dm 3 y oxígeno con una masa de 5,76 g.
Solución . Usando las fórmulas (1.12) y (1.17) encontramos la cantidad química de gases y mezclas:
n (O 2) = m (O 2) M (O 2) = 5,76 32 = 0,18 (mol),
norte (N 2) = V (N 2) V m = 1,12 22,4 = 0,05 (mol).
De este modo,
n (mezclas) = n (O 2) + n (N 2) = 0,05 + 0,18 = 0,23 (mol).
Usando la fórmula (1.25) encontramos las fracciones en volumen de gases en la mezcla:
φ (norte 2) = 0,05 0,23 = 0,217,
φ (O 2) = 0,18 0,23 = 0,783
o (dado que la mezcla consta de dos gases):
φ(O2) = 1 − 0,217 = 0,783.
Usando la fórmula (1.29) encontramos la masa molar de la mezcla:
M (mezclas) = M (O 2) φ (O 2) + M (N 2) φ (N 2);
M (mezclas) = 32 ⋅ 0,783 + 28 ⋅ 0,217 = 31,2 (g/mol).
Respuesta: 31,2 g/mol.
1. La masa molar de una mezcla de gases está entre los valores de la masa molar del gas más ligero y más pesado de la mezcla. Por ejemplo, la masa molar de una mezcla de NH 3 (M = 17 g/mol) y CO 2 (M = 44 g/mol), dependiendo de las fracciones volumétricas de los gases, puede tomar valores 17.< M (смеси) < 44 (г/моль).
2. Si las masas molares de los gases en una mezcla son iguales, entonces la masa molar de la mezcla no depende de las fracciones en volumen de los gases individuales. Por ejemplo, la masa molar de una mezcla de CO, C 2 H 2 y N 2 es siempre 28 g/mol, independientemente de las fracciones en volumen de los componentes.
3. Si se añade un gas a una mezcla de gases, cuyo M es mayor que el M del gas más pesado de la mezcla, entonces M (de la mezcla) aumenta. Por ejemplo, si se añade CO 2 a mezclas de N 2 y O 2 de diferentes composiciones, entonces M (de la mezcla) aumentará.
4. Si se agrega un gas a una mezcla de gases, cuyo M es menor que el M del gas más ligero de la mezcla, entonces el M (mezcla) de la mezcla disminuye. Por ejemplo, si se añade He a mezclas de Ne y Ar de diferentes composiciones, entonces M (de la mezcla) disminuirá.
5. Si las fracciones volumétricas de los gases en la mezcla son iguales, la masa molar de la mezcla es igual a la media aritmética de las masas molares de los gases individuales. Por ejemplo, para una mezcla de volúmenes iguales de CO 2 y O 2:
M (mezclas) = M (O 2) + M (CO 2) 2 = 32 + 44 2 = 38 g/mol.
Instrucciones
Conociendo una cantidad como la cantidad de sustancia ν, encuentre el número moléculas en él. Para ello, multiplica la cantidad de sustancia medida en moles por la constante de Avogadro (NA=6,022∙10^23 1/mol), que es igual al número moléculas en 1 mol de sustancia N=ν/NA. Por ejemplo, si hay 1,2 moles de sal de mesa, entonces contiene N = 1,2∙6,022∙10^23 ≈7,2∙10^23 moléculas.
Vídeo sobre el tema.
Por supuesto, ningún gas real (incluido el oxígeno) es ideal, por lo que la ecuación de Mendeleev-Clapeyron puede usarse para cálculos sólo en condiciones que no difieren mucho de las normales.
La molécula tiene dimensiones tan pequeñas que el número de moléculas, incluso en un pequeño grano o gota de cualquier sustancia, será simplemente enorme. No se puede medir utilizando métodos de cálculo convencionales.
¿Qué es un “mol” y cómo usarlo para encontrar la cantidad de moléculas en una sustancia?
Para determinar cuántas moléculas hay en una determinada cantidad de una sustancia, se utiliza el concepto de “mol”. Un mol es la cantidad de una sustancia que contiene 6,022*10^23 de sus moléculas (o átomos, o iones). Este enorme valor se llama “constante de Avogadro” y lleva el nombre del famoso científico italiano. El valor se denomina NA. Usando la constante de Avogadro, puedes determinar muy fácilmente cuántas moléculas están contenidas en cualquier número de moles de cualquier sustancia. Por ejemplo, 1,5 moles contienen 1,5*NA = 9,033*10^23 moléculas. En los casos en los que se requiere una precisión de medición muy alta, es necesario utilizar el valor del número de Avogadro con gran cantidad lugares decimales. Su valor más completo es: 6.022 141 29(27)*10^23.
¿Cómo puedes encontrar el número de moles de una sustancia?
Determinar cuántos moles contiene una determinada cantidad de una sustancia es muy sencillo. Para ello sólo necesitas tener fórmula exacta Sustancias y tabla periódica a mano. Digamos que tienes 116 gramos de sal de mesa normal. ¿Necesita determinar cuántos moles contiene tal cantidad (y, en consecuencia, cuántas moléculas hay)?
En primer lugar, recuerda la fórmula química de la sal de mesa. Tiene este aspecto: NaCl. La molécula de esta sustancia consta de dos átomos (más precisamente, iones): sodio y cloro. ¿Cuál es su peso molecular? Está formado por las masas atómicas de los elementos. Usando la tabla periódica, sabes que la masa atómica del sodio es aproximadamente 23 y la masa atómica del cloro es 35. Por lo tanto, la masa molecular de esta sustancia es 23 + 35 = 58. La masa se mide en unidades de masa atómica, donde Se toma como estándar el átomo más ligero: el hidrógeno.
Y conociendo la masa molecular de una sustancia, puedes determinar inmediatamente su masa molar (es decir, la masa de un mol). El caso es que numéricamente la masa molecular y molar son completamente iguales, solo que tienen diferentes unidades de medida. Si el peso molecular se mide en unidades atómicas, entonces la masa molar se mide en gramos. Por tanto, 1 mol de sal de mesa pesa aproximadamente 58 gramos. Y según las condiciones del problema, tienes 116 gramos de sal de mesa, es decir, 116/58 = 2 moles. Multiplicar 2 por la constante de Avogadro determina que hay aproximadamente 12,044*10^23 moléculas en 116 gramos de cloruro de sodio, o aproximadamente 1,2044*10^24.
Fuentes:
- cómo determinar el número de moléculas
