Rumus bilangan Avogadro dalam kimia. Kamus kimia atau buku referensi kimia. Bagian i. kimia umum
1. Konsep dasar, definisi dan hukum kimia
1.3. Kuantitas kimia suatu zat. mol. Masa molar
Kuantitas kimia suatu zat. mol. Masa molar
Saat mengkarakterisasi sebagian zat yang diambil, gunakan massa atau volumenya. Namun, untuk tujuan yang sama, Anda juga dapat menunjukkan jumlah unit struktural dalam suatu bagian suatu zat. Mengetahui nomor ini sangat penting karena reaksi kimia zat berinteraksi dalam hubungan yang sebanding dengan jumlah unit struktural, dan bukan massa. Misalnya, notasi 2H 2 + O 2 = 2H 2 O berarti bahwa jumlah (tetapi bukan massa!) molekul H 2 dan O 2 yang bereaksi masing-masing berhubungan sebagai 2: 1.
Besaran suatu zat merupakan salah satu dari tujuh besaran pokok yang ditetapkan Sistem internasional unit. Faktanya, ini adalah tambahan terbaru dalam daftar, yang ditambahkan setelah Konferensi Umum Berat dan Ukuran ke-14, yang diadakan di Unit Dasar Harmonisasi Internasional untuk jumlah suatu zat yaitu mol. Ini kemudian menemukan jalannya bahasa Inggris seperti ngengat.
Kata “zat” dapat memiliki beberapa arti, bergantung pada konteks penggunaannya. Jadi sebelum kita membahas cara mengukur materi, ada baiknya kita mendefinisikan dengan tepat apa yang kita maksud ketika kita berbicara tentang substansi dalam konteks fisika—atau dalam konteks sains yang lebih luas secara umum. Untuk keperluan pembahasan berikut ini, kita akan menggunakan kata “materi” untuk mendeskripsikan materi yang mempunyai komposisi dan sifat tertentu.
Untuk kemudahan penghitungan jumlah unit struktural, yang kandungannya dalam setiap bagian terukur suatu zat sangat besar, besaran fisika baru diperkenalkan - jumlah suatu zat, yang dalam perhitungan kimia juga disebut jumlah kimia suatu zat. zat.
Kuantitas kimia suatu zat- besaran fisika yang sebanding dengan jumlah unit struktural (atom, molekul, unit fisik) yang terkandung dalam suatu bagian suatu zat.
Pada dasarnya, suatu zat adalah unsur murni atau senyawa murni apa pun. Tembaga adalah unsur logam murni dan karenanya merupakan suatu zat. Sulfur dioksida adalah senyawa kimia murni. Jadi, sulfur dioksida juga merupakan suatu zat. Air asin- Larutan garam dalam air bukanlah suatu zat. Ini adalah campuran dua zat - garam dan air. Komposisi larutan air garam tidak tetap, karena perbandingan garam dan air dapat sangat bervariasi.
Atom, molekul, ion, dan partikel atau kelompok partikel lainnya – yang secara kolektif dikenal sebagai entitas elementer – adalah bahan penyusun materi. Bahkan sejumlah kecil materi tersusun dari hal-hal yang hampir tak terbayangkan jumlah besar formasi dasar ini. Mereka sangat kecil sehingga kita tidak dapat melihatnya bahkan di bawah mikroskop. Tentu saja, hal-hal tersebut bukanlah sesuatu yang dapat kita ukur atau hitung dengan mudah. Namun, ada ciri-ciri materi lain yang dapat kita ukur, seperti massa, volume, suhu, dan tekanan.
Kuantitas kimia dilambangkan dengan huruf n (lebih jarang ν).
Satuan besaran kimia suatu zat adalah mol.
Mol adalah bagian suatu zat yang mengandung unit struktural dasar sebanyak jumlah atom yang terkandung dalam bagian nuklida C-12 dengan berat 12 g.
Jumlah atom pada bagian nuklida C-12 yang ditunjukkan adalah sekitar 6,02 ⋅ 10 23. Besaran fisis yang sama dengan 6,02 ⋅ 10 23 mol −1 disebut Konstanta Avogadro dan dilambangkan dengan N A:
Mol memberi kita cara mudah untuk mengasosiasikan besaran-besaran ini dengan sejumlah objek dasar tertentu. Jika kita mengetahui massa suatu sampel, kita dapat menghitung berapa mol zat yang diwakilinya. Dengan informasi ini kita dapat menentukan berapa banyak objek dasar yang dikandungnya dengan tingkat akurasi yang wajar. Hal ini penting dalam banyak cabang ilmu pengetahuan, namun khususnya penting dalam bidang kimia. Dengan kata lain, mol membantu kita memaksimalkan efisiensi konversi suatu proses kimia. Intinya, mol memberi kita cara mudah untuk menghitung sejumlah besar benda, baik itu atom, molekul, elektron, atau jeli.
NA = 6,02 ⋅ 10 23 mol − 1 = 6,02 ⋅ 10 23 mol − 1 .
Satuan pembilang dalam nilai N A tidak dicantumkan, karena untuk kasus yang berbeda bisa berbeda-beda, misalnya:
N A = 6,02 ⋅ 10 23 atom mol,
NA = 6,02 ⋅ 10 23 molekul mol,
NA = 6,02 ⋅ 10 23 FU mol.
Arti fisis dari konstanta Avogadro adalah nilai numeriknya (6,02 ⋅ 10 23) menunjukkan jumlah unit struktural dalam 1 mol suatu zat. Misalnya, 1 mol natrium (m = 23 g) mengandung 6,02 ⋅ 10 23 atom Na; 1 mol asam sulfat (m = 98 g) mengandung 6,02 ⋅ 10 23 molekul H 2 SO 4; 1 mol kalsium karbonat (m = 100 g) mengandung 6,02 ⋅ 10 23 satuan rumus CaCO 3.
Dalam hal ini, ini seperti "selusin". Seperti yang pasti Anda ketahui, selusin berarti dua belas hal. Misalnya, kita mungkin mempunyai selusin telur, selusin kelinci, atau selusin kapal pendarat. ada sesuatu mol, ini berarti kita mempunyai 022 × 10 23 dari sesuatu itu. Kalau ditulis lengkap tampilannya seperti ini.
Kami sebenarnya telah membulatkan nilainya menjadi tiga angka penting untuk menjaga semuanya tetap teratur, tapi mudah-mudahan Anda mengerti. Hal ini menunjukkan seberapa besar angkanya - dan seberapa kecil atom-atomnya jika terdapat begitu banyak atom dalam dua belas gram karbon - yang kira-kira sama dengan massa dua sendok teh gula. Jumlah materi yang kita hadapi dalam situasi tertentu dapat didefinisikan sebagai jumlah entitas dasar. Entitas unsur dapat berupa atom, molekul, ion, elektron, atau partikel lain atau kelompok tertentu dari partikel tersebut.
Mol adalah bagian suatu zat yang mengandung 6,02 ⋅ 10 23 unit strukturalnya
Banyaknya satuan struktur suatu zat N (B) dan jumlah kimia suatu zat n (B) dihubungkan oleh relasi
n (B) = N (B) N A , (1.8)
N (B) = n (B)NA . (1.9)
Mengetahui jumlah kimia suatu zat, Anda dapat menggunakan rumus kimianya untuk menghitung jumlah kimia masing-masing atom yang menyusun komposisinya.
Anda dapat menganggap entitas unsur sebagai jumlah terkecil suatu zat yang dapat ada dan masih dapat diidentifikasi sebagai milik zat tersebut - misalnya, salah satu atom tembaga atau satu molekul sulfur dioksida. Mengetahui dengan tepat entitas dasar mana yang kita hadapi dalam situasi tertentu sangatlah penting dari sudut pandang stoikiometri. Stoikiometri adalah salah satu cabang ilmu kimia yang mempelajari tentang penghitungan jumlah relatif bahan kimia yang akan ikut serta dalam suatu reaksi kimia tertentu.
Hukum perbandingan volumetrik gas
Sangat penting untuk dipahami bahwa ketika kita berbicara tentang jumlah materi, kita mengambil sejumlah entitas dasar. Penting juga untuk dipahami bahwa ketika kita berbicara tentang kuantitas suatu zat, kita harus menentukan dengan tepat apa esensi dasarnya. Hal ini diperlukan untuk menghindari ambiguitas. Oksigen adalah suatu unsur, jadi kita dapat berasumsi bahwa objek unsur dengan jumlah oksigen tertentu adalah atom oksigen. Namun, pada suhu dan tekanan standar, dua atom oksigen bergabung membentuk molekul oksigen, gas diatomik.
Satu mol zat apa pun mengandung jumlah atom kimia yang sama dengan jumlah atom dalam satu molekul (satuan rumus) zat tersebut
Misalnya:
- molekul P4 mengandung 4 atom P, dan 1 mol P4 mengandung 4 mol atom P;
- satuan rumus Na 3 PO 4 mengandung 3 atom Na, 1 atom P dan 4 atom O, dan 1 mol Na 3 PO 4 mengandung 3 mol atom Na, 1 mol atom P dan 4 mol atom O.
Dengan bertambahnya (penurunan) jumlah kimia suatu zat, jumlah kimia atom-atom penyusunnya meningkat (berkurang) secara proporsional. Contoh: 0,5 mol Na 3 PO 4 mengandung 3 · 0,5 = 1,5 (mol) atom Na; 5 mol P4 mengandung 5 4 = 20 (mol) atom P.
Sebenarnya ada tujuh unsur diatomik, yang sebagian besar mungkin pernah Anda dengar. Ini adalah hidrogen, nitrogen, oksigen, fluor, klor, yodium dan brom. Ambiguitas dapat dihindari dalam kasus seperti ini dengan mengganti istilah “zat” dengan nama orangnya atau dengan memberikan rumus untuk zat tersebut.
Dalam senyawa kimia seperti metana, ikatan antar atom disebut ikatan kovalen. Ini pada dasarnya berarti bahwa atom-atom terikat bersama melalui berbagi elektron karena hal ini memberi mereka stabilitas yang lebih besar. Atom hidrogen mempunyai satu elektron, namun membutuhkan elektron lain untuk stabil. Atom karbon memiliki enam elektron, namun memerlukan empat elektron tambahan untuk stabil.
Untuk perhitungan seperti itu, Anda dapat menggunakan apa yang disebut skema stoikiometri. Prinsip penyusunan skema stoikiometri dan melakukan perhitungan ditunjukkan dengan menggunakan contoh K 2 SO 4 dengan jumlah kimia 0,3 mol:
x = n (K) = 0,3 ⋅ 2 1 = 0,6 (mol);
y = n (S) = 0,3 ⋅ 1 1 = 0,3 (mol);
z = n (O) = 0,3 ⋅ 4 1 = 1,2 (mol).
Konsep mol berlaku untuk semua zat, tetapi konsep molekul tidak berlaku untuk semua zat, melainkan hanya untuk zat yang memiliki struktur molekul. Misalnya, kedua konsep tersebut dapat diterapkan dalam kasus air (air memiliki struktur molekul), namun dalam kasus kalsium karbonat (struktur non-molekul), hanya konsep “mol” yang dapat diterapkan.
Molekul metana tercipta ketika empat atom hidrogen berikatan dengan satu atom karbon. Masing-masing dari empat elektron milik atom hidrogen terhubung ke salah satu dari empat elektron milik atom karbon. Ini berarti setiap atom hidrogen menerima satu elektron, dan atom karbon menerima empat elektron. Hasil akhirnya adalah setiap atom mendapatkan elektron ekstra yang dibutuhkan untuk mencapai stabilitas, dan semua orang senang.
Oksigen, klor, dan metana adalah contoh zat yang ada di alam sebagai molekul terpisah. Ikatan kovalen yang terbentuk antara atom-atom dalam suatu molekul bersifat kuat, namun gaya antarmolekul—gaya tarik-menarik dan tolak-menolak antarmolekul yang bertetangga—relatif lemah. Namun, tidak semua senyawa kimia tersusun dari molekul yang terpisah.
Konsep "mol" juga digunakan dalam kasus ion, elektron, proton, neutron, dan ikatan kimia. Misalnya, jika N (PO 4 3 −) = 3,01 ⋅ 10 23, maka
n (PO 4 3 −) = 3,01 ⋅ 10 23 / 6,02 ⋅ 10 23 = 0,5 (mol);
N(e) = 1,505 ⋅ 10 22,
n (e) = N (e) / N A = 1,505 ⋅ 10 22 / 6,02 ⋅ 10 23 = 0,025 (mol);
2 mol molekul H2 (H–H) mengandung 2 mol ikatan hidrogen-hidrogen, dan 3 mol molekul H2O (H–O–H) mengandung 6 mol ikatan H–O (setiap molekul mengandung dua ikatan H–O) .
Seperti ikatan kovalen, beberapa molekul mempunyai jenis ikatan lain yang disebut ikatan ionik. Ikatan ionik hampir selalu terjadi antara logam dan nonlogam. Dalam ikatan ionik, elektron berpindah seluruhnya dari satu atom ke atom lainnya, menghasilkan dua ion yang bermuatan berlawanan. Suatu logam kehilangan elektron menjadi ion bermuatan positif yang disebut kation, sedangkan non-logam memperoleh elektron tersebut menjadi ion bermuatan negatif yang disebut anion. Kation dan anion yang tercipta dengan cara ini terikat satu sama lain melalui gaya tarik elektrostatis.
Massa molar M (B) adalah besaran fisika yang sama dengan perbandingan massa suatu zat dengan besaran kimianya:
M (B) = m (B) n (B) . (1.10)
Dari ekspresi (1.10) ikuti rumus untuk menghitung massa suatu zat:
m (B) = n (B) ⋅ M (B) (1.11)
dan kuantitas kimianya:
n (B) = m (B) M (B) . (1.12)
Karena pada n(B) = 1 mol nilai numerik n(B) dan M(B) adalah sama, sering dikatakan massa molar adalah massa 1 mol suatu zat. Hal ini tentu saja tidak benar, karena hanya nilai numerik dari besaran-besaran tersebut yang sama, tetapi arti fisis dan satuan pengukurannya berbeda.
Salah satu senyawa kimia yang pasti Anda kenal adalah natrium klorida, yang lebih dikenal dengan garam biasa. Natrium klorida merupakan senyawa ionik karena ikatan antara atom natrium dan klor bersifat ionik. Natrium klorida tidak ada sebagai molekul terpisah. Dalam bentuk padat, ion-ion membentuk struktur kisi di mana setiap ion dikelilingi oleh enam ion yang muatannya berlawanan, seperti yang ditunjukkan di bawah ini. Dalam larutan air, ion natrium dan ion klorida dikelilingi oleh molekul air.
Apa itu “mol” dan bagaimana menggunakannya untuk mengetahui jumlah molekul dalam suatu zat
Lalu, bagaimana kita menunjukkan "esensi unsur" untuk natrium klorida? Kami nyatakan di atas bahwa pembentukan unsur dapat dianggap sebagai jumlah terkecil suatu zat yang dapat ada namun dapat diidentifikasi sebagai milik zat tersebut. Ketika natrium dan klor bereaksi bersama menjadi natrium klorida, satu atom natrium menyuplai elektron ke satu atom klor. Rasio ion natrium dan klorida dalam kisi kristal yang dihasilkan adalah satu banding satu. Oleh karena itu, "esensi unsur" natrium klorida dapat terdiri dari satu ion natrium dan satu ion klorida.
Dengan menggunakan massa molar, Anda dapat dengan mudah menghitung massa molekul atau satuan rumus suatu zat:
m mol, FE = M (B) N A. (1.13)
Selain itu, massa molar dapat dicari dengan menggunakan rumus
M (B) = m mol, FE ⋅ N A. (1.14)
Mudah untuk menunjukkan bahwa bila menggunakan satuan massa molar gram per mol, nilai numeriknya sama:
- dengan A r untuk zat sederhana berstruktur atom:
A r (O) = 16, M (O) = 16 g mol;
Aturan untuk menyusun persamaan ionik
Karena alasan ini, kita cenderung memperlakukan unsur unsur senyawa ionik seperti natrium klorida sebagai rumus daripada molekul. Kita juga mencatat bahwa jumlah materi ditentukan oleh jumlah entitas unsur materi yang kita miliki. Faktanya, satu mol suatu zat mengandung sejumlah entitas dasar yang sangat spesifik. Bilangan ini didefinisikan oleh apa yang disebut konstanta Avogadro, dan saat ini didefinisikan sebagai.
Penurunan rumus zat berdasarkan fraksi massa unsur
Dengan ketidakpastian relatif 0 × 10 -8. Setiap atom karbon-12 terdiri dari enam proton, enam neutron, dan enam elektron. Alasan pemilihan karbon-12 sebagian besar bersifat historis. Penting untuk dicatat di sini bahwa massa atom relatif suatu unsur dinyatakan dalam satuan massa yang dikenal sebagai satuan massa atom terpadu. Satu satuan massa atom kira-kira sama dengan massa satu nukleon. Ini didefinisikan sebagai sepersebelas massa atom karbon-12 netral yang tidak terikat.
- M r zat kompleks dengan struktur molekul dan non-molekul:
M r (H 2 O) = 18, M (H 2 O) = 18 g mol;
M r (KOH) = 56, M (KOH) = 56 g mol.
Memang:
M (B) = m mol (B) ⋅ N A = M r (B) ⋅ u ⋅ N A = M r (B) ⋅ 1 N A ⋅ N A = M r (B)
M (B) = m di ⋅ N A = A r (B) ⋅ u ⋅ N A = A r (B) ⋅ 1 N A ⋅ N A = A r (B) .
Contoh 1.5. Massa suatu molekul suatu zat adalah 7,31 ⋅ 10 −23 g Hitunglah massa molar zat tersebut.
Kita tahu bahwa satu mol zat apa pun mempunyai jumlah formasi unsur yang sama dengan dua belas gram karbon. Kita juga mengetahui bahwa jumlah atom karbon-12 ini beratnya dua belas gram dan massa atom relatif satu atom karbon-12 sama dengan dua belas satuan massa atom tunggal. Sekarang anggaplah kita ingin mengetahui massa satu mol unsur lain. Demi argumen, anggaplah kita ingin mengetahui massa satu mol tembaga.
Saat ini Anda mungkin berpikir bahwa jika kita mengetahui massa satu atom tembaga, kita cukup mengalikan nilai tersebut dengan konstanta Avogadro untuk mendapatkan massa satu mol tembaga - dan tentu saja Anda benar. Faktanya, mari kita lakukan perhitungan ini dan lihat apa yang terjadi. Massa satu atom tembaga adalah 055 × 10 -22 g, sehingga perhitungan kita adalah sebagai berikut.
Larutan. Cara pertama. Dari rumus (1.14) sebagai berikut:
M (B) = m mol (B) ⋅ N A
M (B) = 7,31 ⋅ 10 − 23 g ⋅ 6,02 ⋅ 10 23 1 mol = 44 g/mol.
Cara kedua. Kami menggunakan rumus (1.5):
M r (B) = m mol (B) u = 7,31 ⋅ 10 − 23 g 1,66 ⋅ 10 − 24 g = 44 ;
M (B) = 44 g/mol.
Jawaban: 44 gram/mol.
hukum gas. Campuran gas
Zat dapat berada dalam tiga keadaan agregasi: gas, cair dan padat. Keadaan cair dan padat disebut kental. Untuk sebagian besar zat keadaan agregasi dapat diubah: ketika dipanaskan, padatan mula-mula meleleh, kemudian menguap; Saat didinginkan, gas mula-mula mengembun - berubah menjadi cair, kemudian cairan membeku (mengkristal). Peningkatan tekanan dan penurunan suhu berkontribusi pada transisi suatu zat ke keadaan terkondensasi dengan volume yang lebih kecil (dan sebaliknya - penurunan tekanan dan peningkatan suhu berkontribusi pada transisi suatu zat ke keadaan gas) .
Oleh karena itu, jawaban kita akan mengalami kesalahan pembulatan kecil, namun cukup akurat untuk tujuan kita. Kami hanya mencoba mengilustrasikan satu hal di sini. Untuk melakukan ini, mari kita lihat bagian yang relevan dari tabel periodik. Tembaga memiliki massa atom tunggal 546.
Kami telah mengalokasikan posisi untuk tembaga. Untuk setiap entri dalam tabel periodik, massa atom relatif suatu unsur terletak di bawah nama unsur tersebut. Perhatikan bahwa nilai yang diberikan untuk tembaga adalah 546 - hampir sama dengan jumlah gram yang kita hitung untuk massa satu mol tembaga. Ternyata kita tidak perlu melakukan perhitungan apa pun untuk mencari massa satu mol suatu unsur seperti tembaga. Yang harus kita lakukan hanyalah mengacu pada tabel periodik dan mendapatkan massa atom relatif unsur tersebut.
Tekanan gas dalam wadah tertutup berbanding lurus dengan jumlah molekulnya (atau kuantitas kimianya)
Ketika suatu zat berpindah dari keadaan padat menjadi cair, dan kemudian menjadi gas, jarak antar partikel semakin meningkat, dan dalam kasus gas, jarak ini ratusan kali lebih besar dari ukuran molekul itu sendiri. Oleh karena itu, volume suatu bagian gas tidak ditentukan oleh sifat gas tersebut (ukuran molekulnya), tetapi oleh jarak antar molekul (pada dasarnya, volume yang ditempati suatu gas adalah volumenya). ruang kosong antar molekul).
Jarak antar molekul gas bergantung pada suhu dan tekanan, artinya pada kondisi eksternal yang sama, jarak antar molekul gas yang berbeda adalah sama.
Hal ini menyiratkan proposisi yang dikenal sebagai hukum Avogadro (1811): gas-gas yang bervolume sama pada kondisi yang sama mengandung jumlah molekul yang sama.
Tiga konsekuensi mengikuti hukum Avogadro.
1. Jumlah molekul gas yang berbeda pada tekanan dan suhu yang sama menempati volume yang sama.
2. Dalam kondisi normal (norma: T = 273 K atau 0 °C, p = 101,3 kPa) volume sebagian gas dengan kuantitas kimia 1 mol, atau volume molar V m,
V m = 22,4 dm 3 /mol.
3. Massa dua gas yang volumenya sama dihubungkan sebagai massa molar (molekul relatif). Hubungan ini disebut kepadatan relatif gas A ke gas B dan dilambangkan sebagai D B (A):
m (A) m (B) = D B (A) = M (A) M (B) = M r (A) M r (B) . (1.15)
Dengan menggunakan V m, volume dan kuantitas kimia gas ditentukan:
V (B) = n (B) ⋅ Vm ; (1.16)
n (B) = V (B)/Vm. (1.17)
Rumus (1.15) memungkinkan, dengan mengetahui massa jenis relatif gas yang tidak diketahui X dari gas yang diketahui, untuk menemukan M (M r) dari gas yang tidak diketahui:
M (X) = DB (X) ⋅ M (B). (1.18)
Misalnya, jika massa jenis relatif gas X di udara (M udara = 29 g/mol) adalah 1,517, maka massa molar gas tersebut
M (X) = 29 ⋅ 1,517 = 44 (g/mol).
Massa jenis relatif adalah besaran yang tidak berdimensi dan tidak bergantung pada suhu dan tekanan.
Mengetahui massa molar gas, Anda dapat dengan mudah menghitung massa jenis gas (dalam g/dm 3):
ρ (V) = M (V) V m = M (V) 22.4. (1.19)
Misalnya untuk nitrogen
ρ (N 2) = M (N 2) V m = 28 g/mol 22,4 dm 3 /mol = 1,25 g/dm 3.
Berdasarkan massa jenis suatu gas, massa molarnya ditentukan:
M (B) = ρ(B)V m . (1.20)
Massa jenis suatu gas bergantung pada suhu T dan tekanan P: dengan meningkatnya T dan penurunan P, massa jenisnya berkurang.
Jika massa jenis dua gas sama (ρ 1 = ρ 2), maka massa molar (molekul relatif) keduanya juga sama, yaitu. M 1 = M 2 (dan sebaliknya - jika massa molar gas sama, maka massa jenisnya juga sama)
Dalam kasus gas, hal ini juga berlaku Hukum hubungan volumetrik Gay-Lussac(1805–1808): dalam reaksi kimia, volume gas yang bereaksi dan gas yang dihasilkan berhubungan sebagai bilangan bulat kecil yang sama dengan koefisien stoikiometrinya
Misalnya saja untuk reaksinya
4NH 3 + 5O 2 = 4NO + 6H 2 O
V (NH 3) V (O 2) = 4 5;
V (O 2) V (TIDAK) = 5 4.
Contoh 1.6. Massa jenis relatif (rs) beberapa gas X dalam argon adalah 1,2. Temukan massa molekul gas X.
Solusi. Dengan menggunakan rumus (1.18), kita mencari massa molar gas X:
M (X) = D Ar (X) ⋅ M (Ar) ,
M (X) = 1,2 ⋅ 40 = 48 g/mol.
Dengan menggunakan rumus (1.13), kita menghitung massa molekul gas X:
m mol (X) = M (X) NA = 48 6,02 ⋅ 10 23 = 7,97 ⋅ 10 − 23 (g).
Anda juga dapat menggunakan rumus (1.7):
m mol (X) = M r (X) u = 48 ⋅ 1,66 ⋅ 10 − 24 = 7,97 ⋅ 10 − 23 (g).
Jawaban: 7,97 ⋅ 10 −23 gram.
Metode pengumpulan gas. Konsentrasi gas molar
Mari kita pertimbangkan metode laboratorium untuk mengumpulkan gas. Ada dua metode seperti itu (Gbr. 1.1).
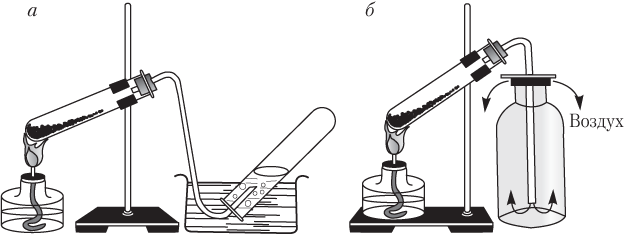
Beras. 1.1. Metode laboratorium untuk mengumpulkan oksigen dengan memanaskan KMnO 4:
A - metode perpindahan air; b - metode perpindahan udara
Jelas sekali metode perpindahan air Anda hanya dapat mengumpulkan gas-gas yang tidak larut dalam air dan tidak berinteraksi dengannya (hidrogen, metana, nitrogen, oksigen). Cara ini tidak dapat digunakan untuk mengumpulkan gas-gas yang larut dengan baik dalam air atau berinteraksi dengannya (HCl, HBr, HI, HF, NH 3). Karbon monoksida (IV) CO 2 relatif sulit larut dalam air, sehingga dapat dikumpulkan dengan menggunakan metode ini.
Saat mengumpulkan gas metode perpindahan udara Anda perlu memposisikan tabung dengan benar:
- neck up jika gas lebih berat dari udara, mis. M (gas) > M (udara). Contoh: CO 2, SO 2, HCl;
- leher ke bawah, jika gas lebih ringan dari udara, mis. M (gas)< M (возд) . Примеры: H 2 , Ne, NH 3 , CH 4 .
Untuk karakteristik gas menggunakan konsentrasi molar c, sama dengan perbandingan jumlah kimia gas dengan volume sebagian gas:
c (X) = n (X) V (X)
Campuran gas, seperti gas individual, dicirikan oleh massa molar (molekul relatif), massa jenis ρ, massa jenis relatif D gas lain, serta massa w dan fraksi volume φ masing-masing gas:
M (campuran) = m (campuran) n (campuran), (1.22)
w = m (gas) m (campuran), (1.23)
φ = V (gas) V (campuran), (1.24)
φ = n (gas) n (campuran), (1.25)
D A (campuran) = M (campuran) M (A) , (1.26)
ρ (campuran) = M (campuran) V m = m (campuran) V (campuran) . (1.27)
Massa molar suatu campuran gas dapat dicari dengan mudah dari fraksi volume dan massa molar masing-masing gas:
M (campuran) = M 1 φ 1 + M 2 φ 2 + M 3 φ 3 + ... + M n φ n. (1.28)
Jelas sekali:
φ 1 + φ 2 + φ 3 + ... + φ n = 1.
Untuk campuran dua gas (φ 1 + φ 2 = 1) φ 2 = 1 − φ 1. Kemudian
M (campuran) = M 1 φ 1 + M 2 φ 2 = M 1 φ 1 + M 2 (1 − φ 1) . (1.29)
Contoh 1.7. Tentukan massa molar campuran gas (n.s.) yang terdiri dari nitrogen dengan volume (n.s.) 1,12 dm 3 dan oksigen dengan massa 5,76 g.
Solusi. Dengan menggunakan rumus (1.12) dan (1.17) kita menemukan jumlah kimia gas dan campurannya:
n (O 2) = m (O 2) M (O 2) = 5,76 32 = 0,18 (mol),
n (N 2) = V (N 2) V m = 1,12 22,4 = 0,05 (mol).
Dengan demikian,
n (campuran) = n (O 2) + n (N 2) = 0,05 + 0,18 = 0,23 (mol).
Dengan menggunakan rumus (1.25) kita mencari fraksi volume gas dalam campuran:
φ (N 2) = 0,05 0,23 = 0,217,
φ (O 2) = 0,18 0,23 = 0,783
atau (karena campurannya terdiri dari dua gas):
φ(O 2) = 1 − 0,217 = 0,783.
Dengan menggunakan rumus (1.29) kita mencari massa molar campuran:
M (campuran) = M (O 2) φ (O 2) + M (N 2) φ (N 2);
M (campuran) = 32 ⋅ 0,783 + 28 ⋅ 0,217 = 31,2 (g/mol).
Jawaban: 31,2 gram/mol.
1. Massa molar suatu campuran gas berada di antara nilai massa molar gas yang paling ringan dan yang paling berat dalam campuran tersebut. Misalnya, massa molar campuran NH 3 (M = 17 g/mol) dan CO 2 (M = 44 g/mol), bergantung pada fraksi volume gas, dapat bernilai 17< M (смеси) < 44 (г/моль).
2. Jika massa molar gas-gas dalam suatu campuran adalah sama, maka massa molar campuran tersebut tidak bergantung pada fraksi volume masing-masing gas. Misalnya, massa molar campuran CO, C 2 H 2 dan N 2 selalu 28 g/mol, berapa pun fraksi volume komponennya.
3. Jika suatu gas ditambahkan ke dalam campuran gas, yang Mnya lebih besar dari M gas terberat dalam campuran tersebut, maka M (campuran) bertambah. Misalnya, jika CO 2 ditambahkan ke dalam campuran N 2 dan O 2 yang komposisinya berbeda, maka M (campuran tersebut) akan meningkat.
4. Jika suatu gas ditambahkan ke dalam campuran gas yang Mnya lebih kecil dari M gas yang paling ringan dalam campuran tersebut, maka M (campuran) campuran tersebut berkurang. Misalnya, jika He ditambahkan ke dalam campuran Ne dan Ar yang komposisinya berbeda, maka M (campuran tersebut) akan berkurang.
5. Jika fraksi volume gas dalam campuran sama, maka massa molar campuran sama dengan rata-rata aritmatika massa molar masing-masing gas. Misalnya, untuk campuran CO 2 dan O 2 dengan volume yang sama:
M (campuran) = M (O 2) + M (CO 2) 2 = 32 + 44 2 = 38 g/mol.
instruksi
Mengetahui besaran seperti jumlah zat ν, tentukan bilangannya molekul dalam dirinya. Caranya, kalikan jumlah zat yang diukur dalam mol dengan konstanta Avogadro (NA=6.022∙10^23 1/mol), yang sama dengan bilangan molekul dalam 1 mol zat N=ν/NA. Misalnya, jika ada 1,2 mol garam meja, maka garam tersebut mengandung N = 1.2∙6.022∙10^23 ≈7.2∙10^23 molekul.
Video tentang topik tersebut
Tentu saja, tidak ada gas nyata (termasuk oksigen) yang ideal, sehingga persamaan Mendeleev-Clapeyron hanya dapat digunakan untuk perhitungan dalam kondisi yang tidak jauh berbeda dari kondisi normal.
Molekul memiliki dimensi yang sangat kecil sehingga jumlah molekul bahkan dalam sebutir atau setetes zat pun akan sangat banyak. Hal ini tidak dapat diukur dengan menggunakan metode perhitungan konvensional.
Apa itu “mol” dan bagaimana menggunakannya untuk mengetahui jumlah molekul dalam suatu zat
Untuk menentukan berapa banyak molekul dalam jumlah tertentu suatu zat, konsep “mol” digunakan. Satu mol adalah jumlah suatu zat yang mengandung 6,022*10^23 molekulnya (atau atom, atau ion). Nilai yang sangat besar ini disebut “Konstanta Avogadro”, yang diambil dari nama ilmuwan terkenal Italia. Nilainya ditunjuk NA. Dengan menggunakan konstanta Avogadro, Anda dapat dengan mudah menentukan berapa banyak molekul yang terkandung dalam sejumlah mol zat apa pun. Misalnya, 1,5 mol mengandung 1,5*NA = 9,033*10^23 molekul. Dalam hal diperlukan ketelitian pengukuran yang sangat tinggi, maka perlu menggunakan nilai bilangan Avogadro dengan jumlah besar tempat desimal. Nilai terlengkapnya adalah: 6.022 141 29(27)*10^23.
Bagaimana cara mencari jumlah mol suatu zat?
Menentukan berapa mol yang terkandung dalam sejumlah suatu zat sangatlah sederhana. Untuk melakukan ini, Anda hanya perlu memilikinya rumus yang tepat zat dan tabel periodik yang ada. Katakanlah Anda memiliki 116 gram garam meja biasa. Apakah Anda perlu menentukan berapa mol yang terkandung dalam jumlah tersebut (dan, karenanya, berapa banyak molekul yang ada)?
Pertama-tama, ingat rumus kimia garam meja. Tampilannya seperti ini: NaCl. Molekul zat ini terdiri dari dua atom (lebih tepatnya ion): natrium dan klor. Berapa berat molekulnya? Itu terdiri dari massa atom unsur-unsur. Dengan menggunakan tabel periodik, Anda mengetahui bahwa massa atom natrium kira-kira 23, dan massa atom klor adalah 35. Oleh karena itu, massa molekul zat ini adalah 23 + 35 = 58. Massa diukur dalam satuan massa atom, di mana atom paling ringan diambil sebagai standar - hidrogen.
Dan mengetahui massa molekul suatu zat, Anda dapat segera menentukan massa molarnya (yaitu massa satu mol). Faktanya adalah secara numerik massa molekul dan molar sepenuhnya sama, hanya memiliki satuan pengukuran yang berbeda. Jika berat molekul diukur dalam satuan atom, maka massa molar diukur dalam gram. Jadi, 1 mol garam meja memiliki berat kurang lebih 58 gram. Dan sesuai dengan kondisi soal, Anda mempunyai 116 gram garam meja, yaitu 116/58 = 2 mol. Mengalikan 2 dengan konstanta Avogadro menentukan bahwa terdapat sekitar 12,044*10^23 molekul dalam 116 gram natrium klorida, atau sekitar 1,2044*10^24.
Sumber:
- cara menentukan jumlah molekul
