ADN humain. Décodage de l'ADN. Matériel pour l'analyse de l'ADN
ADN signifie acide désoxyribonucléique. Vous pouvez voir l'ADN à travers microscope puissant, mais il ressemble à une longue molécule, semblable à une échelle de corde torsadée autour de son axe.
La molécule d'ADN est ce qu'on appelle le « passeport » ou le « plan » d'une personne, qui contient toutes les informations la concernant. Il s’agit de la taille, de la structure osseuse, de la forme du crâne, de la structure et de la couleur des cheveux, de la couleur des yeux et autres. caractéristiques. L'ADN est responsable de la copie exacte des cellules en division. Lorsqu'un enfant commence à se développer dans l'utérus, c'est l'ADN qui assure l'identité de toutes les cellules en lisant correctement les informations héréditaires. À la conception enfant à naître reçoit 50 % des molécules d'ADN de la mère et 50 % du père. Des molécules d'ADN individuelles se trouvent dans absolument toutes les cellules du corps humain. L'ADN est composé de seulement quatre composés chimiques : l'adénine, la thymine, la cytosine et la guanine. Ces éléments sont connectés par paires (gènes) et uniquement de cette manière : l'adénine avec la thymine et la cytosine avec la guanine. Ce sont ces paires qui constituent les « échelons » de l’échelle de corde évoquée plus haut. La disposition des paires de molécules dans une chaîne commune est responsable des caractéristiques héréditaires d’une personne.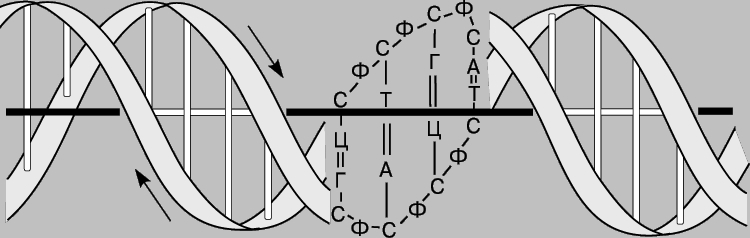
Cytogénétique, représentation du chromosome humain. Dans la représentation en disque, tous les chromosomes ne sont pas représentés par un fragment de code : de nombreux chromosomes sont représentés par deux ou plusieurs fragments. Lorsque cela se produit, nos ancêtres essaient de nous dire que le chromosome est fragile et qu'une cassure peut se produire à ce locus : lorsque cela se produit, nous sommes en présence d'une « délétion », c'est-à-dire de cassures chromosomiques, et le matériel génétique disperse la vie dans des dysfonctionnements génétiques. Nos ancêtres nous montrent clairement où la délétion peut se produire et nous expliquent quelles maladies peuvent être provoquées par la dispersion de ce matériel génétique.
Une autre chose importante à comprendre pour comprendre le code est le phénomène dit de « crossover » : au cours du processus de méiose, les chromosomes se rencontrent et sont capables d'échanger du matériel génétique. Lorsque cela se produit, cela donnera probablement lieu à une maladie génétique. Ceci est également expliqué sur le disque : lorsque nous trouvons un symbole dans un chromosome, nous devrons comprendre que ce chromosome a la capacité d'échanger du matériel génétique avec d'autres, ou nous pouvons aussi l'interpréter comme une « inversion » chromosomique : pratiquement, le chromosome a la capacité de changer de cap !
La découverte de l'ADN en 1868 a permis aux scientifiques de prouver que chaque personne est porteuse d'informations génétiques qui lui sont propres. Aujourd'hui, grâce à l'analyse ADN, les médecins établissent des liens de paternité ou de famille avec une précision de 99,99 %.
À cette époque, ils étaient déjà capables de le faire pour les protéines : la méthode permettant de lire leur séquence a été développée au début des années 1950, avant même la découverte de la double hélice. De plus, les scientifiques avaient déjà une certaine capacité à lire de courtes séquences d’ARN. Mais ils ne pouvaient pas du tout lire les séquences d’ADN. Cela a créé une lacune colossale dans la compréhension réelle des fondements moléculaires de la vie et a entravé à la fois le développement des biotechnologies, qui, à proprement parler, n’existaient pas encore, et l’application médicale de ces connaissances.
Vidéo : qu'est-ce que l'acide désoxyribonucléique
Grâce au message extraordinaire contenu dans le code, Barbara a pu étudier des maladies génétiques telles que la sclérose latérale amyotrophique, le syndrome de Down, l'achondrogenèse, la leucémie myéloïde chronique, le lymphome de Burkitt, l'autisme, la maladie de Tay-Sachs et bien d'autres dysfonctionnements génétiques d'une manière totalement nouvelle. la lumière qui n'est pas n'a rien à voir avec approche scientifique, utilisé par l'humanité de notre temps. Est-il possible qu’en déchiffrant ces découvertes, on puisse réellement démontrer que notre civilisation plus moderne existait déjà ou a visité notre planète dans des temps très anciens ?
Il a même commencé à sembler que c'était un problème trop difficile et qu'il ne serait pas possible de le résoudre - toutes les tentatives ont échoué.
Mais au milieu des années 70 du 20e siècle, une avancée décisive s’est produite. La méthode permettant de déterminer la séquence d'ADN a été développée par le chimiste britannique Frederick Sanger.
Sanger- bonne personne. Il est le seul dans l'histoire des sciences à avoir reçu deux prix Nobel en chimie. Nobel a interdit de décerner deux fois un prix à la même personne dans le même domaine. Et à cette époque, Sanger avait déjà reçu un prix précisément pour avoir développé une méthode de lecture des séquences d'acides aminés dans les protéines. Et lorsqu'il a développé une méthode de lecture de la séquence d'ADN, le Comité Nobel s'est retrouvé dans une position très difficile : il devait soit ne pas décerner de prix à une personne pour une découverte exceptionnelle, soit violer la volonté de Nobel. Après tout, ils ont décidé de briser le testament. Et c’est le seul cas dans le domaine de la chimie.
Nous sommes passés des machettes aux scalpels. Il s’agit d’une autre avancée majeure dans la capacité des biologistes à « réécrire » l’ADN d’une manière simple, précise et peu coûteuse. Comme le lion l'a déjà noté, ce Crisp n'est pas une méthode inventée par l'homme, mais développée par sélection naturelle par les plus petits organismes vivants, des bactéries, il y a des centaines de millions et peut-être des milliards d'années, pour repousser la tentative d'un virus ou autre. matériel génétique étranger" pour entrer dans l'ADN bactérien, le publier et le reproduire de manière totalement gratuite.
Une insertion dans l’ADN d’un organisme vivant rend l’hôte parasitaire, mais s’avère souvent dangereuse pour l’hôte, malgré lui. Ou plutôt une femme, la microbiologiste française Emmanuelle Charpentier, puis plusieurs de ses collègues, dont une autre Jennifer Dudena de l'Université de Californie à Berkeley et Feng Zhang du Massachusetts Institute of Technology de Boston. En bref : la nouvelle technologie élimine les « mauvais » gènes et insère les « bons » avec une précision et une rapidité absolues. De plus, il est facile à utiliser et peu coûteux.
Comment les séquences d’ADN sont-elles lues aujourd’hui ? Depuis lors, d'énormes progrès ont été réalisés dans cette direction, et ils s'appuient sur la percée de Sanger. Une séquence d’ADN est une longueur colossale de texte écrit avec seulement quatre « lettres » – quatre composés chimiques : l’adénine (A), la thymine (T), la guanine (G) et la cytosine (C). Dans chaque cellule, nous avons un génome composé de trois milliards de nucléotides, trois milliards de ces « lettres ».
Quel biotechnologue oserait espérer davantage ? Car, comme le font les explorateurs dans la jungle, la route s'ouvre sans couper les vignes avec une précision absolue, mais grossièrement. Deux équipes de chercheurs de Boston, dont Feng Zhang, ont développé deux systèmes dotés de la précision d'un scalpel.
L'ADN est une longue chaîne formée de milliers, de centaines de milliers et, dans le cas des humains, de trois milliards de bases. Les substances biochimiques sont appelées bases nucléotidiques. En fait, comme James Watson et Francis Crick l’ont découvert dans les années 1950, l’ADN est formé d’une « double hélice » : deux brins complémentaires s’accrochant l’un à l’autre. La séquence des bases le long de l’ADN n’est pas aléatoire, mais détermine les fonctions qui justifient une certaine caractéristique de la « molécule de la vie ». Par exemple, un certain trait agit comme un gène : c’est-à-dire qu’il contient les informations nécessaires à la fabrication des protéines.
Tout d’abord, l’ADN est découpé en fragments à l’aide d’enzymes spéciales appelées enzymes de restriction. Les enzymes de restriction reconnaissent de courtes séquences d'ADN contenant environ 6 à 8 nucléotides et ce n'est qu'à ce stade qu'elles coupent la double hélice de l'ADN d'une manière spécifique. La découverte de ces « ciseaux » a été une autre avancée majeure au début des années 1970.
Eh bien, parfois, il suffit qu'une seule base parmi des milliers ou des dizaines de milliers soit incorrecte - il suffit, disons, pour les généticiens, d'une seule mutation - et le gène ne fonctionne pas ou fonctionne mal. Chez l’homme, on sait que des mutations individuelles dans un seul gène entraînent des maladies graves. C’est le cas par exemple de la drépanocytose. Ou d’autres milliers de maladies monogéniques spécifiques.
C'est pourquoi la capacité de corriger les erreurs dans l'ADN devient d'une grande valeur non seulement avec point scientifique d'un point de vue médical, mais aussi d'un point de vue médical. Nous pourrions, dans un délai plus ou moins long, « réécrire » l’ADN sans erreurs et nous remettre de ces maladies. Les enjeux sont donc très élevés.
Après avoir coupé l'ADN, la tâche consiste à déterminer la séquence d'un court morceau - il peut contenir une centaine ou plusieurs centaines de liens. Et ici, la méthode Sanger est utilisée.
Des adaptateurs spéciaux sont ajoutés au fragment résultant de la molécule aux deux extrémités, car l'enzyme de restriction laisse des extrémités inégales. L'adaptateur a une certaine séquence, que nous choisissons nous-mêmes, puisqu'il est synthétique. Après avoir ajouté l'adaptateur, chaque fragment recevra certaines séquences - que nous connaissons - aux extrémités. Nous pouvons utiliser ces séquences pour ajouter des amorces synthétiques (fragments d'acide nucléique) à un fragment de la molécule, à partir de laquelle une chaîne complémentaire sera synthétisée sur la base de la séquence d'ADN existante.
Faits et événements
L'année dernière, David Liu et son groupe de travailà Meath à Boston, ils ont constaté que le système abandonnait la machette et effectuait une erreur chirurgicale et ponctuelle avec précision et exactitude : une base. Bref, le scalpel a fonctionné, oui, mais seulement dans quelques circonstances.
De cette façon, vous pourrez corriger toutes les erreurs possibles sur l’ADN sans vous répéter à coups de machette. Pour utiliser une autre métaphore, la technique de Liu et de ses collègues fonctionne désormais comme un bon professeur. Identifiez les erreurs d’enregistrement, marquez-les avec un crayon rouge et corrigez-les. Naturellement, même les enseignants peuvent commettre des erreurs. Eh bien, la nouvelle méthode de Liu s'est avérée efficace à 50 % pour effectuer des corrections de base unique dans l'ADN des cellules rénales embryonnaires humaines et des cellules cancéreuses des os. Il ne semble y avoir aucun effet secondaire. La précision a donc été décuplée.
L'idée de Sanger était que cette synthèse impliquerait d'ajouter au mélange de précurseurs nucléotidiques normaux, appelés nucléosides triphosphates, des nucléosides triphosphates spécialement modifiés qui ne pourraient pas s'allonger.
Du coup, la synthèse s'arrête à la place de l'une ou l'autre « lettre ». Ainsi, nous obtenons des molécules avec un ensemble de longueurs qui nous indiquent exactement où telle ou telle « lettre » est incrustée. Il ne reste ensuite plus qu’à séparer ces molécules par longueur, ce qui se fait par électrophorèse sur gel.
Liu a donc raison : il est peut-être possible d’abandonner la machette dans la thérapie génique. Ainsi, être capable de corriger les erreurs qu’ils véhiculent peut être aussi important que de les corriger dans l’ADN. Ainsi, « l'édition de bases », la correction ponctuelle de bases individuelles, s'ajoute à « l'édition de gènes », la couture de séquences entières. Et ceci est également ajouté parce que cela suggère à nouveau les mêmes problèmes bioéthiques. Ces technologies doivent absolument être utilisées car elles ont un énorme potentiel.
Lire la suite : Ils seront bientôt utilisés même sur les humains par de nombreux laboratoires à travers le monde car ils sont légers et peu coûteux. Par conséquent, nous savons que « qui » et « quand » entreront dans nos vies. Il est donc néanmoins nécessaire d’entamer au plus vite un débat public et démocratique pour déterminer le « comment ».
Un gel spécial est préparé, c'est-à-dire un maillage polymère sur lequel un champ électrique constant est appliqué. Sous l’influence d’un champ électrique, des molécules d’ADN chargées négativement rampent à travers le réseau polymère. Et plus la molécule est longue, plus elle se déplace lentement dans le gel. Cela nous permet de séparer un mélange de molécules en fonction de leurs longueurs et de l'endroit où se trouve le nucléotide que nous recherchons. ce momentétude, nous constaterons un arrêt de la synthèse, c'est-à-dire de la longueur des fragments, lorsqu'on les séparera par longueur, correspondant au nombre de ces nucléotides.
Les cellules ont évolué sur des millions d’années, améliorant et améliorant leurs caractéristiques pour survivre dans différents environnements. Cela se produit parce que le génome de l'organisme, c'est-à-dire l'ensemble de son matériel génétique peut être considéré comme un « livret d'instructions » à partir duquel tous les composants biologiques de la cellule peuvent être assemblés.
Si nous pouvions « lire » le génome d’une cellule, nous pourrions au moins prédire parcours théorique, comportement et mécanismes biologiques. En effet, la présence du génome d’une cellule ne permet pas de contrôler totalement sa composition biologique complète. Si nous comparons ce concept à un jeu comme un puzzle, ce que nous obtenons grâce au séquençage, ce sont des pièces. Pour obtenir l'image, vous devez les cadrer avec précision et également avoir une bonne connaissance de l'image qui sera recréée à l'écran.
Cette méthode merveilleuse et ingénieuse, grâce à laquelle nous avons pu séquencer le génome humain, a été inventée par Sanger. Le premier génome humain a été lu au tout début de notre siècle. Cela a ensuite coûté environ trois milliards de dollars. Ensuite, la méthode a été modifiée, robotisée, et aujourd'hui la procédure de détermination de séquence coûte beaucoup moins cher. Le prix approche les 1 000 dollars pour décoder l’ADN d’une personne spécifique.
Cela signifie qu'il est nécessaire d'identifier la fonction de séquences uniques découvertes, c'est-à-dire de comprendre, par exemple, lesquelles codent pour des protéines ou lesquelles sont des parties structurelles non codantes, puis de les insérer dans un contexte plus large, reliant différentes séquences génétiques. éléments et leurs produits finaux. Pour comprendre la fonction d’un gène, par exemple, on peut l’éliminer en le supprimant pour voir l’effet de son absence : un processus d’ingénierie inverse. Bien entendu, le séquençage reste la première étape fondamentale à franchir si nous voulons continuer dans cette direction.
Le développement absolument fantastique des méthodes de séquençage de l’ADN a créé des progrès incroyables tant dans le domaine de la compréhension de la nature moléculaire de la vie que dans le domaine des applications biotechnologiques et médicales.
